题目内容
15.已知磺酰氯(SO2Cl2)是一种有机氯化物,也是锂电池正极活性物质,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.磺酰氯(SO2Cl2)的制备方法及装置图如图1:SO2(g)+Cl2(g)═SO2C12(g)△H<0,

(1)化合物SO2Cl2中S元素的化合价是+6.
(2)仪器D的名称是三颈瓶,仪器C的作用除了吸收氯气和二氧化硫,还具有防止空气中的水进入三颈瓶作用.
(3)戊是贮气装置,则E中的溶液是饱和亚硫酸氢钠溶液;若缺少装置乙和丁,则产物变质,发生反应的化学方程式是SO2Cl2+2H2O=2HCl+H2SO4
(4)反应结束后,将丙中混合物分离开的实验操作是蒸馏.
(5)有关该实验叙述正确的是b
a、X、Y最好的席间组合是铜片和浓硫酸
b、活性炭的作用是作催化剂
c、冷凝管B也可以用作蒸馏
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图2所示,已知电池反应为:2Li+SO2Cl2═2LiCl+SO2↑则电池工作时,正极的电极反应式为是SO2Cl2+2e-=2Cl-+SO2↑.
分析 利用实验室制得的氯气和SO2在木炭作催化剂的作用下合成SO2C12,因SO2Cl2是一种无色液体,极易水解生成硫酸和盐酸,遇潮湿空气会产生白雾,因此要保证参加反应的氯气和SO2是干燥的,同时要防止空气中的水汽进入三颈瓶中,为了减小生成物的损失需要使用冷凝管冷凝回流,同时要利用碱石灰吸收SO2和氯气的尾气防污染,反应后的液体混合物可利用蒸馏进行分离,据此分析作答;
(1)化合物SO2Cl2中O元素为-2价、Cl元素为-1价,设S元素化合价为x,根据化合价规则x+2×(-2)-1=0,据此解出x;
(2)根据仪器D的构造判断其名称;C中碱石灰除吸收含有氯气和二氧化硫的尾气,还可以防止水进入三颈瓶中;
(3)通过E中的溶液排出戊中SO2,因此可选择饱和亚硫酸氢钠溶液;若没有乙和丁的干燥装置,会有水进入三颈瓶中,发生SO2Cl2的水解,据此写出反应方程式;
(4)分离相互混溶的液体混合物的方法为蒸馏;
(5)a.铜片和浓硫酸在加热条件下只能生成SO2,而甲装置是制Cl2的;
b.可选择活性炭催化SO2和Cl2的反应;
c.冷凝管B只起冷凝作用,蒸馏操作应在蒸馏烧瓶内进行;
(6)正极是SO2Cl2中+6价的硫得电子发生还原反应,据此写出该电极反应式.
解答 解:利用实验室制得的氯气和SO2在木炭作催化剂的作用下合成SO2C12,因SO2Cl2是一种无色液体,极易水解生成硫酸和盐酸,遇潮湿空气会产生白雾,因此要保证参加反应的氯气和SO2是干燥的,同时要防止空气中的水汽进入三颈瓶中,为了减小生成物的损失需要使用冷凝管冷凝回流,同时要利用碱石灰吸收SO2和氯气的尾气防污染,反应后的液体混合物可利用蒸馏进行分离,
(1)化合物SO2Cl2中O元素为-2价、Cl元素为-1价,令S元素化合价为x,根据化合价规则x+2×(-2)-1=0,故x=6,即S元素的化合价为+6,
故答案为:+6;
(2)根据构造可知仪器D是三颈瓶;C中碱石灰除吸收含有氯气和二氧化硫的尾气,还可以防止水进入三颈瓶中,避免SO2Cl2水解,
故答案为:三颈瓶;防止空气中的水进入三颈瓶;
(3)通过E中的溶液排出戊中SO2,因此可选择饱和亚硫酸氢钠溶液;若没有乙和丁的干燥装置,会有水进入三颈瓶中,发生SO2Cl2的水解,反应方程式为SO2Cl2+2H2O=2HCl+H2SO4,
故答案为:饱和亚硫酸氢钠溶液;SO2Cl2+2H2O=2HCl+H2SO4;
(4)可利用蒸馏操作分离相互混溶的液体混合物,
故答案为:蒸馏;
(5)a、铜片和浓硫酸在加热条件下只能生成SO2,而甲装置是制Cl2的,应该是浓盐酸和高锰酸钾固体,故错误;
b、可选择活性炭催化SO2和Cl2的反应,故b正确;
c、冷凝管B只起冷凝作用,蒸馏操作应在蒸馏烧瓶内进行,故c错误;
故答案为:b;
(6)正极是SO2Cl2中+6价的硫得电子发生还原反应,所以电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑,
故答案为:SO2Cl2+2e-=2Cl-+SO2↑.
点评 本题考查了制备方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握化学实验基本操作方法,明确制备方案设计与评价的原则,试题培养了学生的分析、理解能力及化学实验能力.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案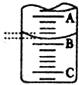 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围 (PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
(2)如图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为25.40ml.此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):$\frac{(25.28+25.32)×c×0.1×60}{2V}$
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
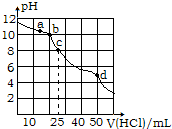
| A. | 该温度下HCO3-的水解常数约为2×10-11 | |
| B. | a点到b点发生的主要离子反应为:HCO3-+H+═H2O+CO2↑ | |
| C. | c点:c(OH-)+c(CO32-)=c(H+)+2c(H2CO3) | |
| D. | d点:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| A. | 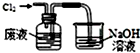 氧化废液中的溴化氢 | B. | 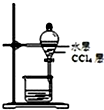 分离CCl4层和水层 | ||
| C. |  分离CCl4和液溴 | D. |  长期贮存液溴 |
| A. |  检验浓硫酸与蔗糖反应产生的二氧化硫 | |
| B. |  分离甲苯和水 | |
| C. |  测量氨气的体积 | |
| D. |  进行二氧化碳喷泉实验 |
 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:(1)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形.
(2)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.MgO晶体的熔点高于NaCl晶体主要原因是MgO晶体中所含离子半径小、电荷数多,晶格能大.其中基态C1-的核外电子排布式为:1s22s22p63s23p6.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 | 900 |
(5)CuCl42-是黄色的,而CuCl2的稀溶液是浅蓝色,说明原因稀溶液中主要形成[Cu(H2O)4]2+配离子.
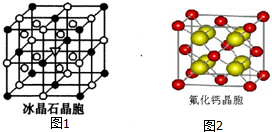
(6)在电解冶炼铝的过程中加入冰晶石(Na3AlF6),可起到降低A12O3熔点的作用.冰晶石由两种微粒构成,冰晶石的晶胞结构如图1甲所示,●位于大立方体的顶点和面心,O位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是Na+(填具体的微粒符号).
(7)已知CaF2晶体(如图2),其中Ca2+的配位数为8.CaF2晶体的密度为ρg•cm-3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
| A. | Ag+ | B. | CO32- | C. | OH- | D. | Mg2+ |
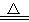 2NH3↑+CO2↑+H2O
2NH3↑+CO2↑+H2O
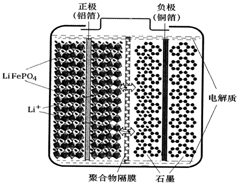 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.