题目内容
17.下列关于电解质溶液的叙述正确的是( )| A. | 常温下,相同浓度的盐酸与氨水的混合溶液的pH=7,消耗盐酸的体积大 | |
| B. | 将pH=5的醋酸溶液稀释1000倍,溶液的pH=8 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
分析 A.盐酸与氨水等物质的量反应恰好生成氯化铵,氯化铵显酸性;
B.醋酸加水稀释,促进醋酸的电离;
C.pH相同的盐酸与醋酸,醋酸的浓度大;
D.Na2S的水解程度大于NaHS.
解答 解:A.盐酸与氨水等物质的量反应恰好生成氯化铵,氯化铵显酸性,若要溶液显中性,则需要减少盐酸的量,所以消耗盐酸的体积小,故A错误;
B.醋酸加水稀释,促进醋酸的电离,溶液中氢离子的物质的量增大,所以将pH=5的醋酸溶液稀释1000倍,溶液的pH<8,故B错误;
C.pH相同的盐酸与醋酸,醋酸的浓度大于氢离子的浓度,盐酸的浓度等于氢离子的浓度,所以醋酸的浓度大于盐酸,所以中和pH与体积均相同的盐酸和醋酸溶液,醋酸消耗NaOH的物质的量大,故C错误;
D.Na2S的水解程度大于NaHS,所以常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大,故D正确.
故选D.
点评 本题考查了酸碱混合溶液定性判断及盐类水解,明确弱电解质电离特点及盐类水解特点即可解答,注意溶液中电荷守恒的应用,题目难度不大.

练习册系列答案
相关题目
7.下列图示实验正确的是( )
| A. |  检验浓硫酸与蔗糖反应产生的二氧化硫 | |
| B. |  分离甲苯和水 | |
| C. |  测量氨气的体积 | |
| D. |  进行二氧化碳喷泉实验 |
8.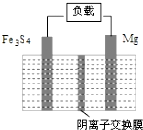 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )| A. | 放电时,镁电极为负极 | |
| B. | 放电时,正极的电极反应式为Fe3S4+8e-=3Fe+4S2- | |
| C. | 充电时,阴极的电极反应式为MgS+2e-=Mg+S2- | |
| D. | 充电时,S2-从阴离子交换膜左侧向右侧迁移 |
5.某溶液中大量存在Ca2+、H+、Cl-,该溶液中还可能大量存在的离子是( )
| A. | Ag+ | B. | CO32- | C. | OH- | D. | Mg2+ |
1.如表是元素周期表主族元素的一部分.短周期元素Y的最外层电子数是最内层电子数的2倍,Z单质可在空气中燃烧.下列叙述错误的是( )
| X | |||
| Y | Z | W |
| A. | Z的最高价氧化物的水化物是强酸 | |
| B. | Y的最高价氧化物能溶于烧碱溶液 | |
| C. | X与W形成的化合物中含有离子键 | |
| D. | Z、W分别形成的简单离子中,前者的半径较大 |




