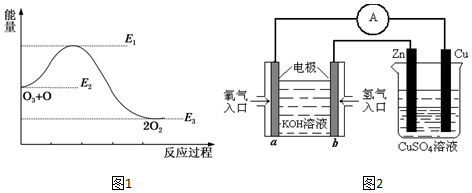
题目内容
15. 用如图所示装置制取乙酸乙酯.请回答下列问题:
用如图所示装置制取乙酸乙酯.请回答下列问题:(1)试管A中盛放的药品是乙醇.乙酸和浓H2SO4.浓浓H2SO4的作用是催化剂 和吸水剂;为防止加热时液体发生爆沸,还应当加入碎瓷片.
(2)试管A中发生反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(3)试管B中盛放的是饱和碳酸钠溶液 溶液,它的作用是中和挥发出的乙酸
溶解挥发出的乙醇.(至少答2条)
(4)试管B中通蒸气的导管要置于液面上,不能插入溶液中,目的是防止倒吸.
(5)实验结束时试管B中的现象是分层,上层为油状液体.要将乙酸乙酯分离出来,应采用分离和提纯的方法是分液.
分析 (1)乙醇和乙酸发生的是酯化反应,产物除乙酸乙酯外还有水且为可逆反应,再考虑浓硫酸具有吸水性,脱水性,强氧化性,结合反应即可解答;液体加热要加碎瓷片,防止暴沸;
(2)乙醇和乙酸发生的是酯化反应,产物是乙酸乙酯和水且为可逆反应,可结合原子守恒书写化学方程式,并注意反应条件;
(3)试管B中盛放的溶液为饱和碳酸钠溶液,饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(4)导管伸入液面下可能发生倒吸;
(5)乙酸乙酯不溶于水且密度比水小,可结合产物乙酸乙酯的性质来分析现象及选择分离和提纯的方法.
解答 解:(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化作用,吸水作用;液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸;
故答案为:催化剂;碎瓷片;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$ CH3COOC2H5+H2O;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯等,
故答案为:饱和碳酸钠溶液;中和挥发出的乙酸、溶解挥发出的乙醇;
(4)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸;故答案为:防止倒吸;
(5)因产物不溶于水且密度比水上,试管B中看到的现象为出现分层,上层为油状液体,互不相溶的液体混合物可选择分液进行分离提纯,故答案为:分层,上层为油状液体;分液.
点评 本题考查了乙酸乙酯的制备,解答时须注意酯化反应的原理和饱和碳酸钠溶液的作用及分液操作适用的对象,基础考查,题目难度不大.

| A. | v(C)=0.2mol•L-1•s-1 | B. | z=3 | ||
| C. | B的转化率为25% | D. | C平衡时的浓度为0.5mol•L-1 |
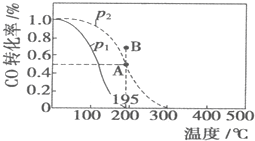 在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示
在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | P1>P2,a<0 | |
| B. | 在P2及195℃时,反应前3min的平均速率v(CH3OH)=0.08mol/(L•min) | |
| C. | 在P2及195℃时,该反应的平衡常数为25(mol/L)-2 | |
| D. | 在B点时,v正>v逆 |
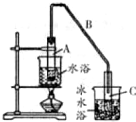 某化学小组以环己醇
某化学小组以环己醇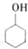 制备环己烯:已知
制备环己烯:已知| 密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
①写出环已醇制备环已烯的化学反应方程式

②A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
③试管C置于冰水浴中的目的是冷却,防止环己烯挥发.
(2)环已烯粗品中含有环已醇和少量酸性杂成等.需要提纯.
①加入饱和食盐水,振荡、静置、分层,水在下层(填上或下).分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是除去环已烯中混有的少量水.
③收集产品时,控制的温度应在83℃左右.
(3)以下区分环已烯精品和粗品的方法,合理的是b.
a.用酸性高锰酸钾溶液b.用金属钠 c.溴水.
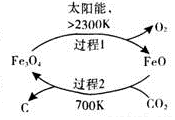 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O.已知298K和101KPa条件下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(l)△H=-b kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-c kJ•mol-1,
则CH3OH(l)的标准燃烧热△H=a+c-1.5b kJ•mol-1.
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0在恒容密闭容器中充入2mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图1所示.

①平衡常数KA>KB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
A.通入一定量H2 B.通入一定量CH2=CH2C.加入合适催化剂 D.缩小容器体积
在图2中画出CH2=CH2的浓度随反应时间的变化
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
B.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图3是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是BD
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2.常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7,Ka2=5×10-11,则0.5mol•L-1的Na2CO3溶液的pH等于12(不考虑第二步水解和H2O的电离)
| A. | NaHCO3=Na++H++CO32- | B. | Fe2(SO4)3=2Fe3++3SO42- | ||
| C. | MgCl2=Mg2++2Cl- | D. | NaOH=Na++OH- |
| 实验 | 操作 | |
| A | 证明某溶液中存在Fe2+ | 先加少量氯水,再滴加KSCN溶液,出现血红色 |
| B | 测定熔融苛性钠的导电性 | 在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C | 证明氯的非金属性大于碳 | 向碳酸钙中滴加盐酸,有气泡产生 |
| D | 制备氯化镁晶体 | 将MgCl2溶液在氯化氢的气流中蒸干 |
| A. | A | B. | B | C. | C | D. | D |