题目内容
7. 二氧化碳的回收利用是环保领域研究热点.
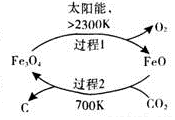
二氧化碳的回收利用是环保领域研究热点.(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O.已知298K和101KPa条件下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(l)△H=-b kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-c kJ•mol-1,
则CH3OH(l)的标准燃烧热△H=a+c-1.5b kJ•mol-1.
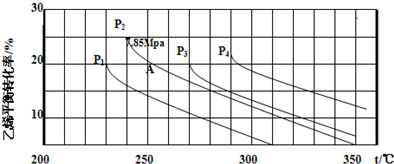
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0在恒容密闭容器中充入2mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图1所示.

①平衡常数KA>KB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
A.通入一定量H2 B.通入一定量CH2=CH2C.加入合适催化剂 D.缩小容器体积
在图2中画出CH2=CH2的浓度随反应时间的变化
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
B.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图3是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是BD
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2.常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7,Ka2=5×10-11,则0.5mol•L-1的Na2CO3溶液的pH等于12(不考虑第二步水解和H2O的电离)
分析 (1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式;
(2)1mol甲醇完全燃烧生成稳定氧化物放出的热量为甲醇的燃烧热,①CO2(g)+3H2(g)=CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
②2H2(g)+O2(g)=2H2O(l)△H=-b kJ•mol-1;
③CH3OH(g)=CH3OH(l)△H=-c kJ•mol-1,
根据盖斯定律,根据②×$\frac{3}{2}$-①-③计算CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H的焓变即可;
(3)①温度越高,二氧化碳的转化率降低,所以反应逆向进行,得到反应是放热的,温度升高,K减小;
②20~30min间各组分的浓度都增加,所以可能是缩小容器体积的结果,相当于增大压强,会引起平衡的移动,据此画出CH2=CH2的浓度随反应时间的变化情况曲线;
(4)根据影响产物产率的因素只能是引起平衡移动的因素,根据平衡移动原理来解释;
(5)根据Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$计算c(OH-),再计算pH.
解答 解:(1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2,
故答案为:CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2;
(2)1mol甲醇完全燃烧生成稳定氧化物放出的热量为甲醇的燃烧热,①CO2(g)+3H2(g)=CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
②2H2(g)+O2(g)=2H2O(l)△H=-b kJ•mol-1;
③CH3OH(g)=CH3OH(l)△H=-c kJ•mol-1,
根据盖斯定律,②×$\frac{3}{2}$-①-③得到CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l),所以反应的△H=(-$\frac{3b}{2}$+a+c)kJ/mol=a+c-1.5b kJ•mol-1,故答案为:a+c-1.5b kJ•mol-1;
(3)①温度越高,二氧化碳的转化率降低,所以反应逆向进行,得到反应是放热的,温度升高,K减小,即平衡常数KA>KB;故答案为:>;
②20~30min间各组分的浓度都增加,所以可能是缩小容器体积的结果,相当于增大压强,CH2=CH2的浓度随反应时间的变化情况曲线如下: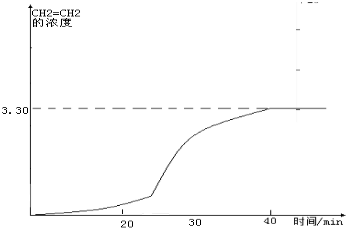 (在20-30分钟内曲线突然变陡),故答案为:D;
(在20-30分钟内曲线突然变陡),故答案为:D; (在20-30分钟内曲线突然变陡);
(在20-30分钟内曲线突然变陡);
(4)影响产物产率的因素只能是引起平衡移动的因素,反应的活化能增大因素都是和催化剂有关的因素,催化剂只能改变反应速率,不会引起平衡移动,乙烯产率不会影响,反应的平衡常数变大是温度的变化引起的,反应是放热的,平衡常数变大是因为升高温度,不符合题意,故选BD;
(5)根据Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Kw}{K2}$=$\frac{1{0}^{-14}}{5×1{0}^{-11}}$=2×10-4=$\frac{{c}^{2}(O{H}^{-})}{0.5}$,所以c(OH-)=10-2mol/L,pH=12.故答案为:12.
点评 本题综合考查学生盖斯定律的应用、化学平衡的移动以及水解常数的表达式及计算等,题目难度大,侧重于考查学生对基础知识的应用能力和应用能力.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 1mol•L-1 | B. | 3mol•L-1 | C. | 2mol•L-1 | D. | 4mol•L-1 |
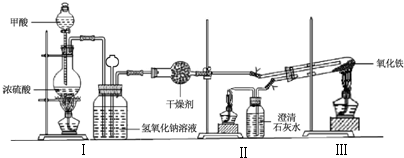
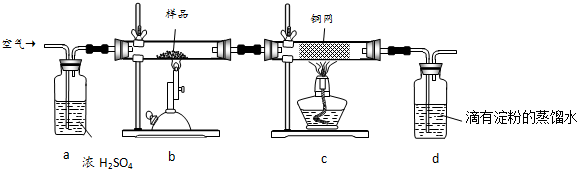
①按上图连接好装置,检查装置气密性.
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后熄灭酒精灯,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为分液漏斗,该反应的化学方程式HCOOH$→_{加热}^{浓硫酸}$CO↑+H2O.
(2)实验步骤③某项操作是指检验CO纯度.
(3)实验步骤④熄灭酒精灯的顺序为III、I、II.(填Ⅰ,Ⅱ,Ⅲ)
(4)通过查资料获取如下信息:
Ⅰ.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃.
Ⅱ.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4.试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度.
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%.
利用仪器分析测出3种样品所含元素种类和各元素的质量分数如表:
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为12:1.(要求保留整数)
 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
(1)实验完毕后,生成物中水的质量为1.8 g,假设广口瓶里生成一种正盐,其质量为5 g;
(2)生成的水中氢元素的质量为0.2 g;
(3)生成的二氧化碳中碳元素的质量为0.6 g;
(4)该燃料中碳元素与氢元素的质量比为3:1;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为CH4O,结构简式为CH3OH.
| A. | 过氧化钠和水反应:2O22-+2H2O=4OH-+O2↑ | |
| B. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 硫化钠水溶液呈碱性:S2-+H2O?HS-+OH- |
| A | B | C | D | |
| 方案 | 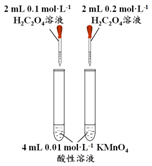 | 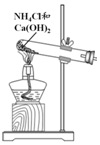 | 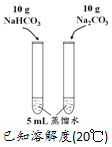 NaHCO3:9.6 g Na2CO3:21.8 g | 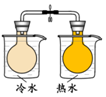 将NO2球浸泡在冷水和热水中 |
| 目的 | 探究浓度对化学反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
| A. | A | B. | B | C. | C | D. | D |
 用如图所示装置制取乙酸乙酯.请回答下列问题:
用如图所示装置制取乙酸乙酯.请回答下列问题: