题目内容
8.到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=-a kJ•mol-1;E(H-H)=b kJ•mol-1,E(Cl-Cl)=c kJ•mol-1,则:E(H-Cl)=$\frac{a+b+c}{2}$KJ/mol;
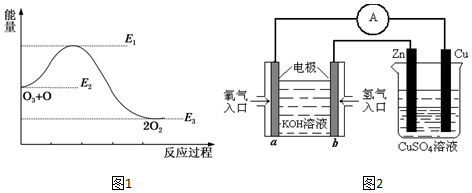
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1,ClO(g)+O(g)=Cl(g)+O2(g)△H2,大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为E1-E2kJ•mol-1.
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-a kJ•mol-1
②C(石墨)+O2(g)═CO2(g)△H=-b kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-c kJ•mol-1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=(-2c-b+a)kJ•mol-1kJ•mol-1.
又已知:该反应为放热反应,△H-T△S可作为反应方向的判据,当△H-T△S<0时可自发进行;则该反应在什么条件下可自发进行低温.(填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为阳极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L.
分析 (1)根据反应热=反应物的键能-生成物的键能来分析;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1-E2;
(3)已知①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-a kJ•mol-1
②C(石墨)+O2(g)═CO2(g)△H=-b kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-c kJ•mol-1
由盖斯定律可知,②+2×③-①可得C(石墨,s)+2H2(g)═CH4(g)△H;
(4)分析装置图可知左边为原电池,是氢氧燃料电池,氧气一端为原电池正极,氢气一端电极为原电池负极,右边装置为电解池,与a相连的铜电极为阳极,与b电极连接的锌电极为电解池的阴极,依据原理分析写出电极反应,结合电子守恒计算.
解答 解:(1)由于反应热=反应物的键能-生成物的键能,设E(H-Cl)为Xmol,故有:E(H-H)+E(Cl-Cl)-2X=-akJ/mol,即bkJ/mol+ckJ/mol-2X=-aKJ/mol
解得X=$\frac{a+b+c}{2}$KJ/mol,故答案为:$\frac{a+b+c}{2}$KJ/mol;(1)(a+b+c)/2 kJ•mol-1(2分),
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1-E2;
故答案为:E1-E2;
(3)已知①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-a kJ•mol-1
②C(石墨)+O2(g)═CO2(g)△H=-b kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-c kJ•mol-1
由盖斯定律可知,②+2×③-①可得C(石墨,s)+2H2(g)═CH4(g)△H=(-2c-b+a) kJ•mol-1,
又该反应为放热反应,△H<0,又△S<0,所以该反应在低温下△H-T△S<0可自发进行;
故答案为:(-2c-b+a) kJ•mol-1;低温;
(4)装置图可知左边为原电池,是氢氧燃料电池,氧气一端为原电池正极,氢气一端电极为原电池负极,右边装置为电解池,与a相连的铜电极为阳极,与b电极连接的锌电极为电解池的阴极,当铜片的质量变化为12.8g时物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu-2e-=Cu2+;a电极反应为O2+2H2O+4e-=4OH-,依据电子守恒得到O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,
故答案为:阳;2.24.
点评 本题考查了化学反应的能量变化与反应的键能关系的分析判断,盖斯定律,反应活化能的判断计算,图象的综合应用,读懂图象,焓变和活化能计算方法的理解是解题的关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案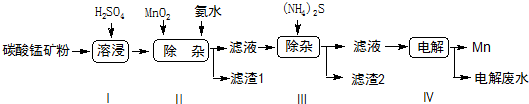
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,则该反应过程中的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是CoS和NiS.
(4)步骤Ⅳ中,在阴(填“阴”或“阳”)极析出Mn,电极反应方程式为Mn2++2e-=Mn.
(5)已知:S(s)+O2(g)=SO2(g)△H=a kJ•mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s)△H=b kJ•mol-1
MnO2(s)+SO2(g)=MnSO4(s)△H=c kJ•mol-1,则Mn的燃烧热△H=-( a+c-b) kJ•mol-1.
(6)按照图示流程,含MnCO3质量分数为57.5%的碳酸锰矿a kg,最终得到Mn的质量为110b kg,忽略中间过程的损耗,则除杂质时,所引入的锰元素相当于MnO2174b-0.435akg.[MnCO3摩尔质量115g/mol,MnO2摩尔质量87g/mol].
| A. | 活性炭 | B. | 氯气 | C. | 明矾 | D. | 次氯酸钠 |
| A. | 氧化钠的电子式: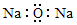 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: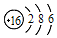 | |
| D. | CCl4的球棍模型: |
| A. | HCl | B. | NH4Cl | C. | NaHSO4 | D. | H2SO4 |
| A. | 1mol•L-1 | B. | 3mol•L-1 | C. | 2mol•L-1 | D. | 4mol•L-1 |
| A. | x=1 | |
| B. | 平衡时A的浓度为1.5 mol/L | |
| C. | B的转化率为20% | |
| D. | 反应起始和达到平衡时,混合气体的压强比为4:5 |
 用如图所示装置制取乙酸乙酯.请回答下列问题:
用如图所示装置制取乙酸乙酯.请回答下列问题: