题目内容
20.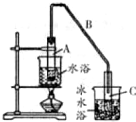 某化学小组以环己醇
某化学小组以环己醇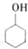 制备环己烯:已知
制备环己烯:已知| 密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
①写出环已醇制备环已烯的化学反应方程式

②A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
③试管C置于冰水浴中的目的是冷却,防止环己烯挥发.
(2)环已烯粗品中含有环已醇和少量酸性杂成等.需要提纯.
①加入饱和食盐水,振荡、静置、分层,水在下层(填上或下).分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是除去环已烯中混有的少量水.
③收集产品时,控制的温度应在83℃左右.
(3)以下区分环已烯精品和粗品的方法,合理的是b.
a.用酸性高锰酸钾溶液b.用金属钠 c.溴水.
分析 (1)①醇在浓硫酸的作用下发生分子内脱水生成烯烃,环己醇在分子内脱水生成环己烯;
②发生装置A中碎瓷片的作用是防止暴沸,由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝;
③冰水浴的目的是降低环己烯蒸气的温度,使其液化;
(2)①环己烯不溶于氯化钠溶液,且密度比水小,分层后环己烯在上层,由于分液后环己烯粗品中还含有少量的酸和环己醇,提纯产物时用c(Na2CO3溶液)洗涤可除去酸;
②生石灰能与水反应生成氢氧化钙,能除去水分;
③根据表中数据可知,馏分环己烯的沸点为83℃;
(3)粗品中含醇,醇与Na反应生成气体,而烯烃不能,以此来鉴别.
解答 解:(1)①环己醇在浓硫酸的作用下分子内脱水生成环己烯,反应为 ,
,
故答案为: ;
;
②发生装置A中碎瓷片的作用是防止暴沸,由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝.
故答案为:防止暴沸;冷凝;
③冰水浴的目的是降低环己烯蒸气的温度,使其液化,
故答案为:冷却,防止环己烯挥发;
(2)①环己烯是烃类,不溶于氯化钠溶液,密度0.81g/cm3,密度比水小,振荡、静置、分层后环己烯在上层,水在下层;由于分液后环己烯粗品中还含有少量的酸和环己醇,不能用酸,也不能用酸性高锰酸钾,否则会氧化环己烯,用c(Na2CO3溶液)洗涤可除去酸,
故答案为:下;c;
②生石灰能与水反应生成氢氧化钙,除去了残留的水,得到纯净的环己烯,
故答案为:除去环已烯中混有的少量水;
③根据表中数据可知,馏分环己烯的沸点为83℃,故收集产品应控制温度在83℃左右,
故答案为:83℃;
(3)区别粗品与精品可加入金属钠,观察是否有气体产生,若无气体,则是精品,而碳碳双键、-OH均与高锰酸钾反应、溴水反应,不能鉴别,故答案为:b.
点评 本题考查有机物的制备实验,为高频考点,把握有机物的性质、发生的反应、混合物分离等为解答的关键,侧重分析与实验能力的考查,注意有机物性质的应用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | HCl | B. | NH4Cl | C. | NaHSO4 | D. | H2SO4 |
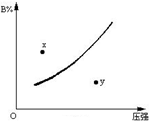 反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | m+n>P | |
| B. | n>p | |
| C. | x点表示该反应的正反应速率小于逆反应速率 | |
| D. | x点比y点时的反应速率慢 |
 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
(1)实验完毕后,生成物中水的质量为1.8 g,假设广口瓶里生成一种正盐,其质量为5 g;
(2)生成的水中氢元素的质量为0.2 g;
(3)生成的二氧化碳中碳元素的质量为0.6 g;
(4)该燃料中碳元素与氢元素的质量比为3:1;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为CH4O,结构简式为CH3OH.
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
 用如图所示装置制取乙酸乙酯.请回答下列问题:
用如图所示装置制取乙酸乙酯.请回答下列问题: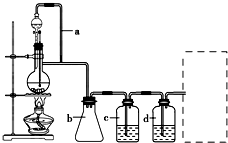 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: .
.