题目内容
11. 利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )
利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 湿润红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 浓盐酸附近产生白烟 | NH3与挥发出的HCl反应:NH3+HCl═NH4Cl |
| D | AlCl3溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
分析 NaOH固体溶于水放热,氨水易挥发,实验时向NaOH固体上滴几滴浓氨水,会产生氨气,为碱性气体,能使湿润的红色石蕊试纸变蓝,与浓硫酸发生中和反应生成硫酸铵,与氯化物发生复分解反应生成氢氧化物,氨水易挥发,与浓盐酸反应生成氯化铵,反应现象是有白烟生成,以此来解答.
解答 解:A.氨气使湿润的红色石蕊试纸变蓝的原因是与水反应生成NH3•H2O,电子生成OH-离子,溶液呈碱性,而不是NH3极易溶于水,因果关系不合理,故A错误;
B.氨气为碱性气体,与浓硫酸发生中和反应生成硫酸铵,但浓硫酸不挥发,解释不合理,故B错误;
C.NaOH固体溶于水放热,氨水易挥发,实验时向NaOH固体上滴几滴浓氨水,会产生氨气,浓盐酸易挥发,发生NH3+HCl═NH4Cl,浓盐酸附近产生白烟,故C正确;
D.氨气与氯化铝发生复分解反应生成氢氧化物,一水合氨在离子反应中保留化学式,则离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选C.
点评 本题考查物质的性质实验评价,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
1.下列说法正确的是( )
| A. | 石油的分馏、煤的干馏都是物理变化 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 可用乙醇萃取溴水中的溴 | |
| D. | 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 |
19.某有机物的结构为 ,下列有关叙述不正确的是( )
,下列有关叙述不正确的是( )
 ,下列有关叙述不正确的是( )
,下列有关叙述不正确的是( )| A. | 不能发生加聚反应 | |
| B. | 分子式为C8H10O | |
| C. | 和足量氢气反应后的生成物中含有羟基 | |
| D. | 能发生银镜反应 |
6.下列说法中正确的是( )
| A. | Na2O2可作漂白剂和供氧剂,碳酸钠可用于治疗胃酸过多 | |
| B. | 工业上用次氯酸制漂白粉,保存漂白粉的塑料袋要密封 | |
| C. | 氯气用于自来水消毒,是因为生成的次氯酸有杀菌、消毒的作用 | |
| D. | 溴化银用于人工降雨,单质碘加入食盐中用于制加碘盐 |
3.下列用于解释实验事实的化学方程式正确的是( )
| A. | Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-=Al(OH)3↓ | |
| B. | 纯碱溶液使酚酞变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | 乙酸清除水垢后的化学反应原理:2H++CO32-=CO2↑+H2O | |
| D. | FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++Fe=3Fe2+ |
20.X2Q的燃烧热为akJ•mol-1,则X2Q燃烧的热化学方程式正确的是( )
| A. | 2X2Q(g)+O2(g)═2Q(s)+2X2O(g)△H=-2a kJ•mol-1 | |
| B. | X2Q(g)+2O2(g)═QO3(g)+X2O(l)△H=+a kJ•mol-1 | |
| C. | 2X2Q(g)+3O2(g)═2QO2(g)+2X2O(l)△H=-2a kJ•mol-1 | |
| D. | X2Q(g)+2O2(g)=QO3(g)+X2O(l)△H=-a kJ•mol-1 |
15.学习化学要准确掌握化学基本概念和研究方法.按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
找出上述三组分类中的错误,错误物质的化学式为Na2CO3、Al2O3.
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液.X可以是D(填代号)
A.NaOH B.AgNO3 C.HCI D.Na2SO4
(3)配平下面化学方程式,回答下列问题:
3C+K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
①H2SO4在上述反应中表现出来的性质是(填选项编号)C.
A.氧化性. B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.48L.
(4)在一个密闭容器中放人M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,按要求回答下列问题:
该变化的基本反应类型是分解反应,Q物质的作用为催化剂.
(1)下列是某同学对有关物质进行分类的列表:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO3 |
| 第三组 | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液.X可以是D(填代号)
A.NaOH B.AgNO3 C.HCI D.Na2SO4
(3)配平下面化学方程式,回答下列问题:
3C+K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
①H2SO4在上述反应中表现出来的性质是(填选项编号)C.
A.氧化性. B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.48L.
(4)在一个密闭容器中放人M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,按要求回答下列问题:
| 物质 | M | N | Q | P |
| 反应前质量(g) | 50 | 1 | 3 | 12 |
| 反应后质量(g) | X | 26 | 3 | 30 |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: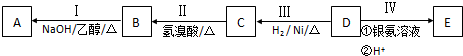
 ;
; ;
;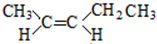 和
和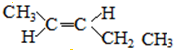 .
.