题目内容
2. 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为11.9mol•L-1.
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是BD(填字母).
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol•L-1的稀盐酸.
①该学生需要量取16.8mL上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(“偏大”、“偏小”、“无影响”).
a.用量筒量取浓盐酸时俯视观察凹液面偏小;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水偏小.
(4)①假设该同学成功配制了0.400mol•L-1的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取25mL盐酸.
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是C.
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出.
分析 (1)根据C=$\frac{n}{V}$=$\frac{1{0}^{3}ρVw}{\frac{M}{V}}$=$\frac{1000ρw}{M}$ 计算;
(2)根据各公式是否与体积有关判断;
(3)①根据C1V1=C2V2计算;
②根据C=$\frac{n}{V}$判断;
(4)①根据氢离子的物质的量等于氢氧根离子的物质的量;
②A.浓盐酸挥发,浓度不足,所以消耗盐酸体积偏大;
B.配制溶液时,未洗涤烧杯,盐酸浓度偏小,所以消耗盐酸体积偏大;
C.配制溶液时,俯视容量瓶刻度线,盐酸浓度偏大,所以消耗盐酸体积偏小;
D.加水时超过刻度线,用胶头滴管吸出,盐酸浓度偏小,所以消耗盐酸体积偏大.
解答 解:(1)C=$\frac{1000ρw}{M}$=$\frac{1{0}^{3}×1.19×36.5%}{36.5}$=11.9mol/L
故答案为:11.9mol/L;
(2)A、n=CV,所以与溶液体积有关,故A不符题意.
B、溶液的浓度是均一稳定的,与所取溶液的体积无关,故B符合题意.
C、N=nNA=CVNA,所以与溶液体积有关,故C不符题意.
D、溶液的密度是均一的,所以与所取溶液的体积无关,故D符合题意.
故选:BD;
(3)①C1V1=C2V2,11.9mol/L×V1=0.400mol•L-1×0.5L,所以V1=0.0168L=16.8mL
故答案为:16.8;
②根据C=$\frac{n}{V}$判断
a.俯视观察凹液面,所取溶液的体积偏大,所以浓度偏小,故答案为:偏小;
b.溶液的体积偏大,所以浓度偏小,故答案为:偏小;
(4)①根据氢离子的物质的量等于氢氧根离子的物质的量,0.4g NaOH的物质的量为$\frac{0.4g}{40g/mol}$=0.01mol:设xmL盐酸,则0.400mol•L-1x×10-3=0.01mol,所以x=25ml,故答案为:25;
②A.浓盐酸挥发,浓度不足,所以消耗盐酸体积偏大,故A不符合;
B.配制溶液时,未洗涤烧杯,盐酸浓度偏小,所以消耗盐酸体积偏大,故B不符合;
C.配制溶液时,俯视容量瓶刻度线,盐酸浓度偏大,所以消耗盐酸体积偏小,故B符合;
D.加水时超过刻度线,用胶头滴管吸出,盐酸浓度偏小,所以消耗盐酸体积偏大,故D不符合;故选:C.
点评 本题考查了物质的量浓度的有关计算及配置一定物质的量浓度的溶液等知识点,难度不大,要注意配置一定物质的量浓度溶液的误差分析,根据C=$\frac{n}{V}$判断,分析变化的物理量,从而确定浓度的变化.

| A. | HCHO--浸制标本 | B. | CH3COOC2H5--香料 | ||
| C. | CH3OH--饮料 | D. | CCl4--灭火剂 |
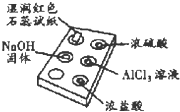 利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )
利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 湿润红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 浓盐酸附近产生白烟 | NH3与挥发出的HCl反应:NH3+HCl═NH4Cl |
| D | AlCl3溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 .
.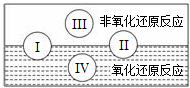 氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
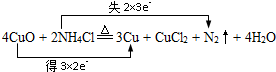 .
.