题目内容
3.下列用于解释实验事实的化学方程式正确的是( )| A. | Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-=Al(OH)3↓ | |
| B. | 纯碱溶液使酚酞变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | 乙酸清除水垢后的化学反应原理:2H++CO32-=CO2↑+H2O | |
| D. | FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++Fe=3Fe2+ |
分析 A.氨水中的一水合氨是弱碱,一水合氨不能拆开,离子方程式中应该保留分子式;
B.碳酸根离子的水解分步进行,离子方程式应该分步书写,主要写出第一步的水解即可;
C.乙酸和碳酸钙都不能拆开,应该保留化学式;
D.氯化铁与铁粉反应生成氯化亚铁,铁离子转化成亚铁离子.
解答 解:A.一水合氨应该保留分子式,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.纯碱是强碱弱酸的盐,盐水解是分步进行的,主要以第一步为主,正确的离子方程式为:CO32-+2H2O?HCO3-+OH-,故B错误;
C.乙酸是弱酸,碳酸钙为难溶物,二者应该写化学式,清除水垢后的化学反应原理为:2CH3COOH+CO32-=CO2↑+H2O+2CH3COO-,故C错误;
D.FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++Fe=3Fe2+,符合反应事实,离子方程式拆写也符合原则,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
14.下列有机物的用途错误的是( )
| A. | HCHO--浸制标本 | B. | CH3COOC2H5--香料 | ||
| C. | CH3OH--饮料 | D. | CCl4--灭火剂 |
11.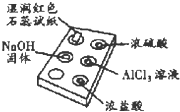 利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )
利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )
 利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )
利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 湿润红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 浓盐酸附近产生白烟 | NH3与挥发出的HCl反应:NH3+HCl═NH4Cl |
| D | AlCl3溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
18. 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6 mol•h-1.
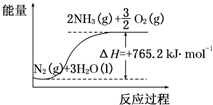
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议:升高温度.
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6 mol•h-1.
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议:升高温度.
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
8.下列措施不符合节能减排的是( )
| A. | 在屋顶安装太阳能热水器为居民提供生活用水 | |
| B. | 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏 | |
| C. | 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气作为家庭燃气 | |
| D. | 大力发展火力发电,解决广东电力紧张问题 |
12.分子式为C6H12O2,能与碳酸氢钠溶液反应放出二氧化碳气体且含有两个甲基的有机物有(不含立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
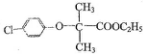
7.对三联苯是一种有机合成的中间体.工业上合成对三联苯的化学方程式为
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 上述反应属于取代反应 | |
| B. | 对三联苯分子中至少有18个原子共平面 | |
| C. | 对三联苯的一氯取代物有4种 | |
| D. | 0.2 mol对三联苯在足量的氧气中完全燃烧消耗5.1 mol O2 |
 )和某聚碳酸酯工程塑料(
)和某聚碳酸酯工程塑料(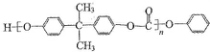 )的原料之-.
)的原料之-.
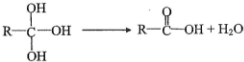
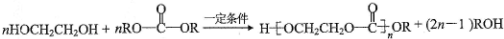
 .
. .
.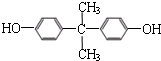 .
.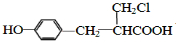 、
、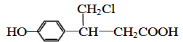 (或
(或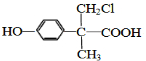 、
、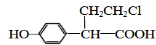 ).
).