题目内容
我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理.
2HI(g)?H2(g)+I2(g)-Q一定温度下,向1L密闭容器中加入1mol HI(g),发生反应,有关物质的量随时间的变化如图1所示.

(1)0~2min内的平均反应速率v(HI)= mol?L-1?min-1,平衡常数表达式为K= .
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍.
A.平衡常数 B.HI的平衡浓度
C.达到平衡的时间 D.平衡时体系压强.
(3)下列措施肯定能使平衡向逆反应方向移动的是的
A.充入少量氨气 B.降温至0℃C.充入少量硫化氢 D.加压.
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3mol?L-1的氨水b L;
②c(OH-)=1.0×10-3mol?L-1的氨水c L;
③c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的关系是: .
(5)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图2所示.则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”);设盐酸中加入的Zn质量m1,醋酸溶液中加入的Zn质量为m2,则m1 m2.(选填“<”、“=”、“>”)
(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图3所示,有关粒子浓度关系的比较正确的是
A.在A、B间任一点,溶液中一定都有
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
2HI(g)?H2(g)+I2(g)-Q一定温度下,向1L密闭容器中加入1mol HI(g),发生反应,有关物质的量随时间的变化如图1所示.

(1)0~2min内的平均反应速率v(HI)=
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
A.平衡常数 B.HI的平衡浓度
C.达到平衡的时间 D.平衡时体系压强.
(3)下列措施肯定能使平衡向逆反应方向移动的是的
A.充入少量氨气 B.降温至0℃C.充入少量硫化氢 D.加压.
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3mol?L-1的氨水b L;
②c(OH-)=1.0×10-3mol?L-1的氨水c L;
③c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的关系是:
(5)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图2所示.则图中表示醋酸溶液中pH变化曲线的是
(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图3所示,有关粒子浓度关系的比较正确的是
A.在A、B间任一点,溶液中一定都有
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
考点:化学平衡常数的含义,化学平衡的影响因素,弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:化学平衡专题,电离平衡与溶液的pH专题
分析:(1)依据图象分析,平衡状态下氢气物质的量为0.1mol,依据反应速率V=
计算,结合化学方程式和平衡常数概念书写平衡常数表达式,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,反应前后气体体积不变,平衡不动,气体物质的量、物质的浓度为原来的2倍,平衡常数随温度变化;
(3)依据化学平衡状态物质性质分析,2HI(g)?H2(g)+I2(g)-Q,反应是气体体积不变的吸热反应;
A.充入少量氨气会和碘化氢发生反应,平衡逆向进行;
B.降温平衡向放热反应方向进行,逆向进行,但碘单质变化为固体后,平衡也可以向正反应方向进行,二者程度大小不同决定平衡移动方向;
C、充入少量硫化氢和碘单质反应,平衡正向进行;
D.反应前后气体体积不变,加压平衡不动;
(4)①将pH=3的盐酸a L与浓度为1.0×10-3mol?L-1的氨水b L溶液混合恰好反应生成氯化铵溶液,铵根离子水解呈酸性,溶液呈中性需要氨水过量;
②将pH=3的盐酸a L与c(OH-)=1.0×10-3mol?L-1的氨水c L,等体积混合,平衡状态下的氢氧根和盐酸溶液中氢离子恰好反应,此时氨水电离平衡正向进行,氢氧根离子增大,若溶液呈中性,需要加入盐酸多;
③将pH=3的盐酸a L与c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d L,等体积合,氢离子和氢氧根恰好反应,溶液呈中性;
(5)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;
(6)在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH 溶液,二者之间相互反应,当恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+),注意根据电荷守恒思想来比较离子浓度大小.
| △c |
| △t |
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,反应前后气体体积不变,平衡不动,气体物质的量、物质的浓度为原来的2倍,平衡常数随温度变化;
(3)依据化学平衡状态物质性质分析,2HI(g)?H2(g)+I2(g)-Q,反应是气体体积不变的吸热反应;
A.充入少量氨气会和碘化氢发生反应,平衡逆向进行;
B.降温平衡向放热反应方向进行,逆向进行,但碘单质变化为固体后,平衡也可以向正反应方向进行,二者程度大小不同决定平衡移动方向;
C、充入少量硫化氢和碘单质反应,平衡正向进行;
D.反应前后气体体积不变,加压平衡不动;
(4)①将pH=3的盐酸a L与浓度为1.0×10-3mol?L-1的氨水b L溶液混合恰好反应生成氯化铵溶液,铵根离子水解呈酸性,溶液呈中性需要氨水过量;
②将pH=3的盐酸a L与c(OH-)=1.0×10-3mol?L-1的氨水c L,等体积混合,平衡状态下的氢氧根和盐酸溶液中氢离子恰好反应,此时氨水电离平衡正向进行,氢氧根离子增大,若溶液呈中性,需要加入盐酸多;
③将pH=3的盐酸a L与c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d L,等体积合,氢离子和氢氧根恰好反应,溶液呈中性;
(5)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;
(6)在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH 溶液,二者之间相互反应,当恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+),注意根据电荷守恒思想来比较离子浓度大小.
解答:
解:(1)依据图象分析,平衡状态下氢气物质的量为0.1mol,消耗HI物质的量为0.2mol,0~2min内的平均反应速率v(HI)=
=
=0.1mol/(L?min),结合化学方程式和平衡常数概念书写平衡常数表达式K=
;
故答案为:0.1mol/(L?min),
;
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,反应前后气体体积不变,平衡不动,气体物质的量、物质的浓度为原来的2倍,平衡常数随温度变化;
A.平衡常数随温度变化,不随浓度变化,故A错误;
B.开始加入HI(g)的物质的量是原来的2倍,反应前后气体体积不变,平衡不动,气体物质的量、HI的平衡浓度为原来的2倍,故B正确;
C.浓度增大,反应速率加快,达到平衡的时间是原来的一半,故C错误;
D.气体物质的量为原来的2倍,平衡时体系压强为原来的2倍,故D正确;
故答案为:BD;
(3)依据化学平衡状态物质性质分析,2HI(g)?H2(g)+I2(g)-Q,反应是气体体积不变的吸热反应;
A.充入少量氨气会和碘化氢发生反应,平衡逆向进行,故A正确;
B.降温平衡向放热反应方向进行,逆向进行,但碘单质变化为固体后,平衡也可以向正反应方向进行,二者程度大小不同决定平衡移动方向,故B错误;
C、充入少量硫化氢和碘单质反应,促进平衡正向进行,故C错误;
D.反应前后气体体积不变,加压平衡不动,故D错误;
故答案为:A;
(4)①将pH=3的盐酸a L与浓度为1.0×10-3mol?L-1的氨水b L溶液混合恰好反应生成氯化铵溶液,铵根离子水解呈酸性,溶液呈中性需要氨水过量,b>a;
②将pH=3的盐酸a L与c(OH-)=1.0×10-3mol?L-1的氨水c L,等体积混合,平衡状态下的氢氧根和盐酸溶液中氢离子恰好反应,此时氨水电离平衡正向进行,氢氧根离子增大,若溶液呈中性,需要加入盐酸多,a>c;
③将pH=3的盐酸a L与c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d L,等体积合,氢离子和氢氧根恰好反应,溶液呈中性,a=d;
所以得到b>a=d>c;
故答案为:b>a=d>c;
(5)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(6)A、在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)<c(OH-),溶液中离子浓度大小关系为:c (Na+)>c (CH3COO-)>c (OH-)>c (H+),若开始滴入醋酸少量,溶液中存在离子浓度大小可以是c (Na+)>c (OH-)>c (CH3COO-)>c (H+),故A错误;
B、在B点溶液显中性,则结果是c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C、在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),c (CH3COO-)>c (Na+)>c (H+)>c (OH-),故C错误;
D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,c(Na+)=0..05mol/L,c (CH3COO-)+c (CH3COOH)=2c (Na+)故D正确;
故答案为:D;
| △c |
| △t |
| ||
| 2min |
| c(H2)?c(I2) |
| c2(HI) |
故答案为:0.1mol/(L?min),
| c(H2)?c(I2) |
| c2(HI) |
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,反应前后气体体积不变,平衡不动,气体物质的量、物质的浓度为原来的2倍,平衡常数随温度变化;
A.平衡常数随温度变化,不随浓度变化,故A错误;
B.开始加入HI(g)的物质的量是原来的2倍,反应前后气体体积不变,平衡不动,气体物质的量、HI的平衡浓度为原来的2倍,故B正确;
C.浓度增大,反应速率加快,达到平衡的时间是原来的一半,故C错误;
D.气体物质的量为原来的2倍,平衡时体系压强为原来的2倍,故D正确;
故答案为:BD;
(3)依据化学平衡状态物质性质分析,2HI(g)?H2(g)+I2(g)-Q,反应是气体体积不变的吸热反应;
A.充入少量氨气会和碘化氢发生反应,平衡逆向进行,故A正确;
B.降温平衡向放热反应方向进行,逆向进行,但碘单质变化为固体后,平衡也可以向正反应方向进行,二者程度大小不同决定平衡移动方向,故B错误;
C、充入少量硫化氢和碘单质反应,促进平衡正向进行,故C错误;
D.反应前后气体体积不变,加压平衡不动,故D错误;
故答案为:A;
(4)①将pH=3的盐酸a L与浓度为1.0×10-3mol?L-1的氨水b L溶液混合恰好反应生成氯化铵溶液,铵根离子水解呈酸性,溶液呈中性需要氨水过量,b>a;
②将pH=3的盐酸a L与c(OH-)=1.0×10-3mol?L-1的氨水c L,等体积混合,平衡状态下的氢氧根和盐酸溶液中氢离子恰好反应,此时氨水电离平衡正向进行,氢氧根离子增大,若溶液呈中性,需要加入盐酸多,a>c;
③将pH=3的盐酸a L与c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d L,等体积合,氢离子和氢氧根恰好反应,溶液呈中性,a=d;
所以得到b>a=d>c;
故答案为:b>a=d>c;
(5)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(6)A、在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)<c(OH-),溶液中离子浓度大小关系为:c (Na+)>c (CH3COO-)>c (OH-)>c (H+),若开始滴入醋酸少量,溶液中存在离子浓度大小可以是c (Na+)>c (OH-)>c (CH3COO-)>c (H+),故A错误;
B、在B点溶液显中性,则结果是c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C、在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),c (CH3COO-)>c (Na+)>c (H+)>c (OH-),故C错误;
D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,c(Na+)=0..05mol/L,c (CH3COO-)+c (CH3COOH)=2c (Na+)故D正确;
故答案为:D;
点评:本题综合考查化学平衡常数、平衡影响因素、反应速率计算、离子浓度大小比较,注意弱电解质电离平衡,电解质溶液中物料守恒以及电荷守恒的应用,难度中等.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
下列气体中所含分子数目最多的是( )
| A、1g H2 |
| B、10g O2 |
| C、30gCl2 |
| D、17g NH3 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、标准状况下,22.4L的H2O所含的分子数为NA |
| B、1mol T2O分子所含的中子数为10NA |
| C、常温常压下,20g D2O分子中所含的质子数为10NA |
| D、1mol H3O+所含的电子数为11NA |

 (或写成
(或写成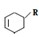 R代表取代基或氢);Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
R代表取代基或氢);Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
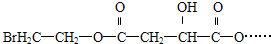
 )的原料,试写出其结构简式
)的原料,试写出其结构简式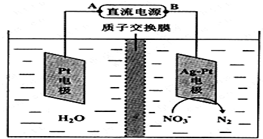 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.