题目内容
下列气体中所含分子数目最多的是( )
| A、1g H2 |
| B、10g O2 |
| C、30gCl2 |
| D、17g NH3 |
考点:物质的量的相关计算
专题:计算题
分析:根据n=
计算选项各物质的物质的量,由N=nNA可知,物质的量越大,含有分子数目越大.
| m |
| M |
解答:
解:A.1g氢气的物质的量=
=0.5mol;
B.10g氧气的物质的量=
≈0.31mol;
C.30g氯气的物质的量=
≈0.42mol;
D.17g氨气的物质的量=
=1mol,
由N=nNA可知,物质的量越大,含有分子数目越大,故17g氨气含有的分子数目最多,
故选D.
| 1g |
| 2g/mol |
B.10g氧气的物质的量=
| 10g |
| 32g/mol |
C.30g氯气的物质的量=
| 30g |
| 71g/mol |
D.17g氨气的物质的量=
| 17g |
| 17g/mol |
由N=nNA可知,物质的量越大,含有分子数目越大,故17g氨气含有的分子数目最多,
故选D.
点评:本题考查物质的量的相关计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关同分异构体数目的叙述不正确的是( )
| A、若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 |
B、与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
| C、含有5个碳原子的饱和链烃,其一氯取代物共有8种 |
D、菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
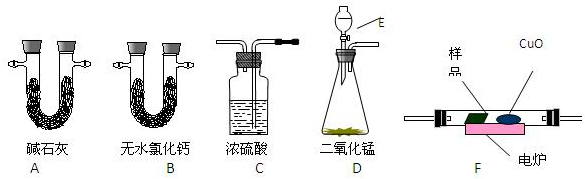
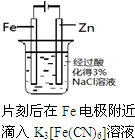
如图实验装置或操作能达到目的是( )
A、 合成氨并检验氨的生成 |
B、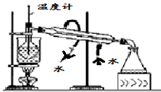 碘的CCl4溶液中分离I2并回收CCl4 |
C、 分离CH3CH2OH和CH3COOC2H5混合液 |
D、 制备Fe(OH)2 |
下列关于2mol?L-1 NaOH 溶液的说法中,不正确的是( )
| A、将80 g NaOH 溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol?L-1 |
| B、1 L溶液中含2 mol NaOH |
| C、溶液中含2 mol钠离子和2 mol氢氧根离子 |
| D、溶液中钠离子的浓度是2 mol?L-1 |
下列有关化学用语的说法中不正确的是( )
A、-OH与 都表示羟基 都表示羟基 |
B、聚丙烯的结构简式: |
C、CH4分子的球棍模型: |
D、次氯酸分子的电子式: |
在下列物质中,既具有氧化性又具有还原性的是( )
| A、铁 | B、硫 | C、铁和硫 | D、氢气 |