题目内容
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和.
(1)A为 ,B为 ,C为 ,D为 .(填元素符号)
(2)D的最高价氧化物的水化物的化学式是 ,E的电子式是 .
(3)写出由A、B组成的化合物与E反应的化学方程式: .
(4)请用电子式表示出C和D形成的化合物F的形成过程: .
(1)A为
(2)D的最高价氧化物的水化物的化学式是
(3)写出由A、B组成的化合物与E反应的化学方程式:
(4)请用电子式表示出C和D形成的化合物F的形成过程:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,固体E为Na2O2,则B为O元素,C为Na元素,A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素,D的L层电子数等于K、M两个电子层上电子数之和,M层电子数=8-2=6,则D为S元素,据此解答.
解答:
解:A、B、C、D四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,固体E为Na2O2,则B为O元素,C为Na元素,A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素,D的L层电子数等于K、M两个电子层上电子数之和,M层电子数=8-2=6,则D为S元素,
(1)由上述分析可知,A为C,B为O,C为Na,D为S,故答案为:C;O;Na;S;
(2)D为S元素,最高价氧化物的水化物的化学式是H2SO4,E为Na2O2,电子式是 ,
,
故答案为:H2SO4; ;
;
(3)由C、O组成的化合物与Na2O2反应,应是过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应化学方程式为2CO2+2Na2O2=2Na2CO3+O2,
故答案为:2CO2+2Na2O2=2Na2CO3+O2;
(4)Na与S形成的化合物为Na2S,属于离子化合物,请用Na原子、S原子电子式表示其形成过程为 ,
,
故答案为: .
.
(1)由上述分析可知,A为C,B为O,C为Na,D为S,故答案为:C;O;Na;S;
(2)D为S元素,最高价氧化物的水化物的化学式是H2SO4,E为Na2O2,电子式是
 ,
,故答案为:H2SO4;
 ;
;(3)由C、O组成的化合物与Na2O2反应,应是过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应化学方程式为2CO2+2Na2O2=2Na2CO3+O2,
故答案为:2CO2+2Na2O2=2Na2CO3+O2;
(4)Na与S形成的化合物为Na2S,属于离子化合物,请用Na原子、S原子电子式表示其形成过程为
 ,
,故答案为:
 .
.
点评:本题考查结构性质位置关系应用,侧重对化学用语的考查,比较基础,注意对基础知识的积累掌握.

练习册系列答案
相关题目
下列关于2mol?L-1 NaOH 溶液的说法中,不正确的是( )
| A、将80 g NaOH 溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol?L-1 |
| B、1 L溶液中含2 mol NaOH |
| C、溶液中含2 mol钠离子和2 mol氢氧根离子 |
| D、溶液中钠离子的浓度是2 mol?L-1 |
下列反应能设计成原电池提供电能的是( )
| A、Cu与Cl2燃烧反应 |
| B、Ba(OH)2?8H2O与NH4Cl反应 |
| C、灼热的炭与CO2反应 |
| D、氢氧化钠溶液与稀盐酸反应 |

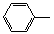 -CH=CH2)和D(HO-
-CH=CH2)和D(HO-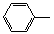 -CHO)按如下方法合成:
-CHO)按如下方法合成: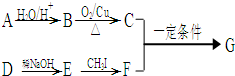
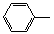 -ONa+RCH2I→
-ONa+RCH2I→ -OCH2R
-OCH2R