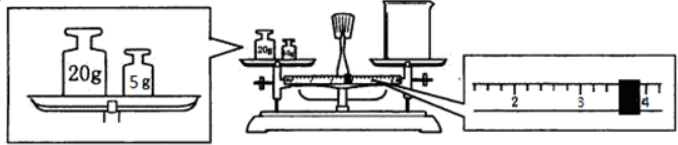
题目内容
12.将100mL0.6mol/L A1Cl3溶液跟0.4mol/L Na0H溶液混合后,得到3.9g氢氧化铝沉淀,此时消耗氢氧化钠的体积是( )| A. | 250mL | B. | 375mL | C. | 475mL | D. | 500mL |
分析 100mL0.6mol/L氯化铝溶液跟1mol/L氢氧化钠溶液混合后,如完全转化为gAl(OH)3沉淀,则生成沉淀的质量为0.6mol/L×0.1L×78g/mol=4.68g,而此时得到3.9gAl(OH)3沉淀,由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知NaOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此进行计算.
解答 解:100mL0.6mol/L氯化铝溶液跟1mol/L氢氧化钠溶液混合后,如完全转化为gAl(OH)3沉淀,则生成沉淀的质量为0.6mol/L×0.1L×78g/mol=4.68g,
而此时为3.9g,说明氯化铝并没有完全转化为Al(OH)3,此时n(Al(OH)3)=$\frac{3.9g}{78g/mol}$=0.05mol,NaOH可能有两种情况,一是不足,二是使Al(OH)3部分溶解,
当NaOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 1mol
x 0.05mol
则x=0.15mol,
V1(NaOH溶液)=$\frac{0.15mol}{0.4mol/L}$=0.375L=375mL;
如使Al(OH)3部分溶解,则
①Al3++3OH-=Al(OH)3↓
0.06mol 0.18mol
②Al(OH)3+OH-=AlO2-+H2O
1mol 1mol
(0.06-0.05)mol (0.06-0.05)mol=0.01mol
两步反应共需要0.18mol+0.01mol=0.19mol,
V2(NaOH溶液)=$\frac{0.19mol}{0.4mol/L}$=0.475L=475mL,
选项中BC符合,
故选BC.
点评 本题考查化学方程式的相关计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意判断氯化铝反应的程度,为解答本题的关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的化学计算能力.

| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,分子间作用力大因而易液化.
②W分子的VSEPR模型的空间构型为四面体型.
③写出AB-离子的电子式:[:C??N:]-.
(3))E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E、F、G三元素的元素符号分别为K、、Cr、Cu.
②F元素在其化合物中最高化合价为+6.
③G2+离子的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9.G2+和N分子形成的配离子的结构式为
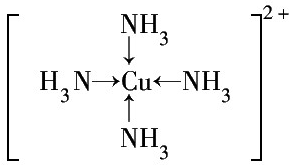 .
. | 数据编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 由表中数据可估算出Ka(HX)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
 .
. ;
;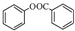 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).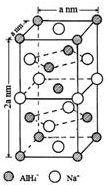 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如右图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如右图所示.  .
.  .
.  (标明配位键).
(标明配位键).