题目内容
3.实验室用Na2CO3•10H2O晶体配制1.0mol/L的Na2CO3溶液240mL.回答下列问题:(1)应用托盘天平称取Na2CO3•10H2O晶体71.5g.
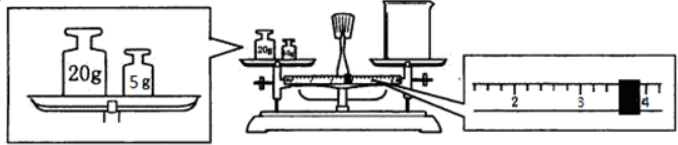
(2)某同学欲称量Na2CO3•10H2O晶体的质量,先用托盘天平称量烧杯的质量,托盘天平平衡后的状态如图所示,烧杯的实际质量为21.4g.
分析 (1)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3•10H2O的质量;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,据此计算.
解答 (1)因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,Na2CO3的物质的量n=cV=0.25L×1.0mol•L-1=0.25mol,Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3•10H2O的质量0.25mol×286g/mol=71.5g,
故答案为:71.5;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,所以实际称得烧杯的质量为25g-3.6g=21.4g,
故答案为:21.4.
点评 本题考查了一定物质的量浓度溶液的配制,明确原理及天平的使用方法是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.化学与环境、材料、信息、生活关系密切,下列说法正确的是( )
| A. | “山东疫苗案”涉疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物质 | |
| C. | 半导体行业中有一句“行话”:“从沙滩到用户”,说明计算机芯片的主要成分是二氧化硅 | |
| D. | 自来水厂常用明矾作消毒杀菌剂 |
15.新型电池在飞速发展的信息技术中发挥着越来越重要的作用.Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用.其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2
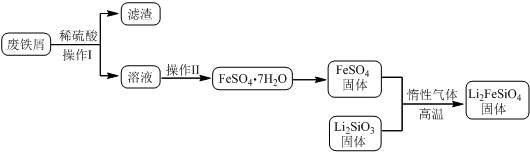
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量.
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
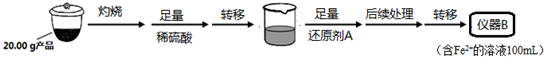
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.经4次滴定,每次消耗KMnO4溶液的体积如下:
(1)实验(二)中的仪器名称:仪器B100ml容量瓶,仪器C酸式滴定管.
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是防止二价铁被氧化.
(3)操作Ⅱ的步骤蒸发浓缩,降温结晶,过滤,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需玻璃棒.
(4)还原剂A可用SO2,写出该反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时后续处理的主要目的是除去过量的SO2,以免影响后面Fe2+的测定.
(5)滴定终点时现象为溶液变为浅红色,且半分钟内不变色;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为81%;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量偏高.(填“偏高”、“偏低”或“不变”).
固相法:2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量.
实验(一)制备流程:

实验(二) Li2FeSiO4含量测定:

从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.经4次滴定,每次消耗KMnO4溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是防止二价铁被氧化.
(3)操作Ⅱ的步骤蒸发浓缩,降温结晶,过滤,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需玻璃棒.
(4)还原剂A可用SO2,写出该反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时后续处理的主要目的是除去过量的SO2,以免影响后面Fe2+的测定.
(5)滴定终点时现象为溶液变为浅红色,且半分钟内不变色;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为81%;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量偏高.(填“偏高”、“偏低”或“不变”).
12.将100mL0.6mol/L A1Cl3溶液跟0.4mol/L Na0H溶液混合后,得到3.9g氢氧化铝沉淀,此时消耗氢氧化钠的体积是( )
| A. | 250mL | B. | 375mL | C. | 475mL | D. | 500mL |
8.为探究硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的影响因素,某课外研究小组做了一系列实验,实验数据如下表:
回答下列问题:
(1)量取液体所用的仪器及规格是量筒,50mL.
(2)为测量某一物质达到某特点值所用的时间,最易测量的物质的是C.
A.Na2S2O3浓度 B.H2SO4的浓度 C.S单质的量 D.SO2的量
(3)实验①、②、③得出的结论是相同温度下,反应物浓度越大,反应速率越快,其中 V1=15mL.
(4)实验④时研究温度对化学反应速度的影响,则 V2=15mL,V3=10mL.
(5)为处理实验后的废液,实验小组向废液中加入少量的NaOH溶液至溶液呈微酸性,发现溶液变澄清,写出发生反应的化学方程式:6NaOH+3S=2Na2S+Na2SO3+3H2O.
| 序号 | 温度 | 0.1mol•L-1Na2S2O3溶液 | 0.1mol•L-1H2SO4溶液 | H2O | 达到相同程度所用的时间/s |
| ① | 25℃ | 25mL | 25mL | 0mL | 4 |
| ② | 25℃ | 25mL | 15mL | 10.0mL | 6 |
| ③ | 25℃ | V1 | 25mL | 10mL | 6 |
| ④ | 45℃ | V2 | 25mL | V3 | 2 |
(1)量取液体所用的仪器及规格是量筒,50mL.
(2)为测量某一物质达到某特点值所用的时间,最易测量的物质的是C.
A.Na2S2O3浓度 B.H2SO4的浓度 C.S单质的量 D.SO2的量
(3)实验①、②、③得出的结论是相同温度下,反应物浓度越大,反应速率越快,其中 V1=15mL.
(4)实验④时研究温度对化学反应速度的影响,则 V2=15mL,V3=10mL.
(5)为处理实验后的废液,实验小组向废液中加入少量的NaOH溶液至溶液呈微酸性,发现溶液变澄清,写出发生反应的化学方程式:6NaOH+3S=2Na2S+Na2SO3+3H2O.
15.下表是几种弱酸常温下的电离平衡常数:
(1)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,则酸性最强的是H3PO4,最弱的是HPO42-.
(2)多元弱酸的二级电离程度远小于一级电离的原因是一级电离产生的H+对二级电离有抑制作用.
(3)温度相同时,同浓度的CH3COO-、HCO3-、CO32-、S2-的水解能力由强到弱的顺序为S2->CO32->HCO3->CH3COO-.
(4)在CH3COONa溶液中在相关离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(5)根据K值大小判断下列反应能否发生:CH3COOH+H2PO4-→不能(填“能”或“不能”,下同) H2CO3+HS-→能.
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(2)多元弱酸的二级电离程度远小于一级电离的原因是一级电离产生的H+对二级电离有抑制作用.
(3)温度相同时,同浓度的CH3COO-、HCO3-、CO32-、S2-的水解能力由强到弱的顺序为S2->CO32->HCO3->CH3COO-.
(4)在CH3COONa溶液中在相关离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(5)根据K值大小判断下列反应能否发生:CH3COOH+H2PO4-→不能(填“能”或“不能”,下同) H2CO3+HS-→能.
13.下列关于元素周期表和元素周期律的说法错误的是( )
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 | |
| B. | 第二周期元素从Li到F,金属性逐渐减弱,非金属性逐渐增强 | |
| C. | 因为Na比K容易失去电子,所以Na比K的还原性强 | |
| D. | O与S为同主族元素,且O比S的非金属性强 |
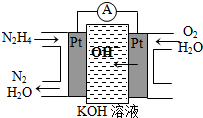 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题