题目内容
7.若配制pH=10.00的NH3-NH4Cl缓冲溶液1L,已知用去15mol•L-1氨水3.5ml,问需加入NH4Cl多少克?分析 查表得:K(NH3)=1.75×10-5,对K(NH3) 取负对数,即得pK(NH3)[如同 pH=-lgc(H+)]
pK(NH3)=-lgK(NH3)=4.76
pOH=pK(NH3)-lg ($\frac{n(N{H}_{3})}{n(N{H}_{4}Cl)}$)
lg($\frac{n(N{H}_{3})}{n(N{H}_{4}Cl)}$)=pK(NH3)-(14-pH)=4.76-4.0=0.76
$\frac{n(N{H}_{3})}{n(N{H}_{4}Cl)}$=5.75
n(NH4Cl)=$\frac{n(N{H}_{3})}{5.75}$=$\frac{1.5mol/L×0.0035L}{5.75}$=0.00091mol,依据物质的量和摩尔质量计算所需氯化铵的质量.
解答 解:查表得:K(NH3)=1.75×10-5,
对K(NH3) 取负对数,即得pK(NH3)[如同 pH=-lgc(H+)]
pK(NH3)=-lgK(NH3)=4.76
pOH=pK(NH3)-lg ($\frac{n(N{H}_{3})}{n(N{H}_{4}Cl)}$)
lg($\frac{n(N{H}_{3})}{n(N{H}_{4}Cl)}$)=pK(NH3)-(14-pH)=4.76-4.0=0.76
$\frac{n(N{H}_{3})}{n(N{H}_{4}Cl)}$=5.75
n(NH4Cl)=$\frac{n(N{H}_{3})}{5.75}$=$\frac{15mol/L×0.0035L}{5.75}$=0.0091mol
m(NH4Cl)=n(NH4Cl)×M(NH4Cl)=0.0091mol×53.5g/mol=0.488g,
答:若配制pH=10.00的NH3-NH4Cl缓冲溶液1L,已知用去15mol•L-1氨水3.5ml,需加入NH4Cl质量为0.488g.
点评 本题考查了缓冲溶液的形成和配制,主要是配制溶液需要的溶质量的计算,题目难度较大.

 寒假学与练系列答案
寒假学与练系列答案| A. | 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,20gD20分子中所含中子数为10NA |
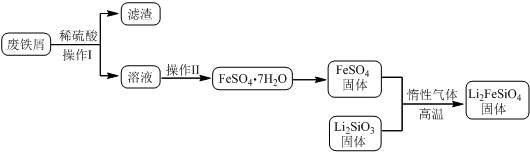
固相法:2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量.
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
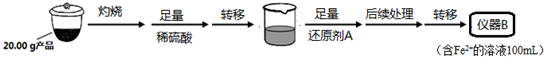
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.经4次滴定,每次消耗KMnO4溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是防止二价铁被氧化.
(3)操作Ⅱ的步骤蒸发浓缩,降温结晶,过滤,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需玻璃棒.
(4)还原剂A可用SO2,写出该反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时后续处理的主要目的是除去过量的SO2,以免影响后面Fe2+的测定.
(5)滴定终点时现象为溶液变为浅红色,且半分钟内不变色;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为81%;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量偏高.(填“偏高”、“偏低”或“不变”).
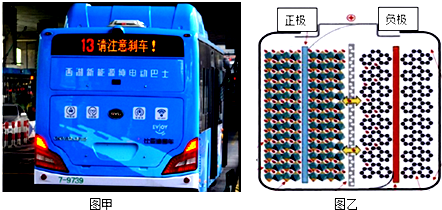
| A. | 充电时阳极反应可表示为LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| B. | 充电时阴极反应可表示为xLi++xe-+6C=LixC6 | |
| C. | 放电时负极反应可表示为LixC6-xe-=xLi++6C | |
| D. | 放电时Li+从左向右通过离子交换膜 |
| A. | 250mL | B. | 375mL | C. | 475mL | D. | 500mL |
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(2)多元弱酸的二级电离程度远小于一级电离的原因是一级电离产生的H+对二级电离有抑制作用.
(3)温度相同时,同浓度的CH3COO-、HCO3-、CO32-、S2-的水解能力由强到弱的顺序为S2->CO32->HCO3->CH3COO-.
(4)在CH3COONa溶液中在相关离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(5)根据K值大小判断下列反应能否发生:CH3COOH+H2PO4-→不能(填“能”或“不能”,下同) H2CO3+HS-→能.
| A. | c[NH3•H2O] | B. | c[H+] | C. | c[OH-] | D. | c[NH4+] |