题目内容
13.(1)室温下,有一pH=12的NaOH溶液100mL,欲使它的pH降为11.①如果加入蒸馏水,就加入900 mL
②如果加入pH=10的NaOH溶液,应加入1000 mL
③如果加入0.008mol/L HCl溶液,应加入100 mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式CO32-+H2O?HCO3-+OH-,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式Al3++3H2O?Al(OH)3+3H+,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+).
| 金属离子 | PH值 | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
分析 (1)①先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积;
②先根据溶液的pH计算氢氧根离子浓度,再根据c1V1+c2V2=c3(V1+V2)计算加入的氢氧化钠溶液体积;
③先计算混合溶液中氢氧根离子浓度,再根据c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{V(酸)+V(碱)}$进行解答;
(2)CO32-水解生成碳酸氢根离子和氢氧根离子;铝离子水解生成氢氧化铝和氢离子;加入硫酸会抑制铝离子的水解;
(3)调节pH时能与氢离子反应,但是不能引入新的杂质;调节pH使Fe3+完全沉淀,而Cu2+不沉淀.
解答 解:(1)①pH=12 的NaOH溶液中氢氧根离子浓度为0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L,V2=$\frac{0.01mol/L×0.1L}{0.001mol/L}$=0.9L=900mL,
故答案为:900;
②pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,
设加入pH=10的NaOH溶液体积是V2,
c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L(0.1+V2),
V2=1L=1000mL,
故答案为:1000;
③0.008mol/L HCl溶液中氢离子浓度为0.008mol/L,设加入盐酸的体积为V,
c(OH-)=$\frac{0.01mol/L×0.1L-0.008mol/LL×V}{0.1L+V}$=0.001mol/L,
解得:V=100mL.
故答案为:100;
(2)CO32-水解生成碳酸氢根离子和氢氧根离子,其水解的离子方程式为:CO32-+H2O?HCO3-+OH-;在配制Al2(SO4)3溶液时,Al3+会部分水解而使溶液呈酸性,水解的离子方程式为Al3++3H2O?Al(OH)3+3H+;为了防止发生水解,可以加入少量的硫酸;
故答案为:CO32-+H2O?HCO3-+OH-;Al3++3H2O?Al(OH)3+3H+;硫酸;
(3)调节pH时能与氢离子反应,但是不能引入新的杂质,所以可加CuO或Cu(OH)2;调节pH使Fe3+完全沉淀,而Cu2+不沉淀,由表中数据可知,pH控制在3.7~4.4;
故答案为:CuO或Cu(OH)2;3.7~4.4.
点评 本题考查溶液pH的简单计算、盐的水解原理的应用、物质的分离提纯,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,明确酸碱中和反应实质为解答本题的关键,试题培养了学生的化学计算能力.

| 温度/℃ | N(B)/mol | N(D)/mol |
| T1 | 0.60 | - |
| T2 | - | 0.35 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{4}{9}$ | |
| C. | T2℃时,若反应达到平衡后再缩小容器的体积,c(C):c(D)不变 | |
| D. | T1℃时,若开始时反应物的用量均减小一半,平衡后A的转化率α(A)减小 |
| A. | 洗净酸式滴定管后,立即装入标准盐酸进行滴定 | |
| B. | 锥形瓶用待测NaOH溶液润洗后,再装入NaOH 溶液进行滴定 | |
| C. | 操作过程中,滴定前平视读数,滴定后仰视读数 | |
| D. | 用酚酞作指示剂滴至红色刚退去,停止滴沄,立即读数 |
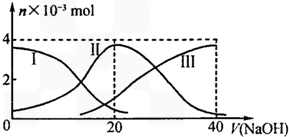 25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| B. | 向Na2A溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 欲使NaHA溶液呈中性,可以向其中加入酸 | |
| D. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:[Na+]>[HA-]>[H+]>[A2-]>[OH-] |
| A. | 实验室制取乙烯气体时,将温度计的水银球放入液面以下 | |
| B. | 可用酒精洗涤沾有苯酚的试管 | |
| C. | 证明分子CH2=CH-CHO既含有醛基又含有碳碳双键,可先向溶液中先加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 | |
| D. | 苯中混有苯酚,加浓溴水,然后过滤 |
| A. | 由Cu.Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.4NA | |
| B. | 18 g D2O中含有的质子数目为10NA | |
| C. | 1 mol Cl2发生反应时,转移的电子数一定是2 NA | |
| D. | 常温常压下,16 g O3所含的原子数为NA |
| A. | 离子半径X>Y>Z | |
| B. | 元素原子得电子能力X>Y>Z | |
| C. | 最高价氧化物对应水化物的酸性强弱X>Y>Z | |
| D. | 单质与氢气反应,X、Y、Z难度依次增大 |
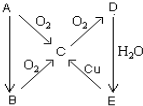 A、B、C、D、E、在一定条件下的转换条件如图所示.
A、B、C、D、E、在一定条件下的转换条件如图所示.