题目内容
8.100℃时,KW=1.0×10-12,若在100℃时某溶液中的c(H+)=1.0×10-7 mol•L-1,则该溶液( )| A. | 呈中性 | B. | 呈碱性 | C. | 呈酸性 | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1 |
分析 在任何溶液中,水的离子积表达式:Kw=c(H+)•c(OH-)成立,并且根据溶液中氢离子和氢氧根离子浓度的相对大小来判断溶液的酸碱性.
解答 解:在100℃时某溶液的[H+]=1.0×10-7 mol•L-1,则[OH-]=1.0×10-5mol/L>1.0×10-7 mol•L-1,即c(H+)<c(OH-),所以溶液显示碱性.
故选B.
点评 本题涉及水的离子积常数以及溶液酸碱性的判断知识,属于教材知识的考查,难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
18.下列实验的操作或所用的试剂有错误的是( )
| A. | 实验室制取乙烯气体时,将温度计的水银球放入液面以下 | |
| B. | 可用酒精洗涤沾有苯酚的试管 | |
| C. | 证明分子CH2=CH-CHO既含有醛基又含有碳碳双键,可先向溶液中先加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 | |
| D. | 苯中混有苯酚,加浓溴水,然后过滤 |
19. 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因HCO3-+H2O?H2CO3+OH-.
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液.
其pH由大到小的顺序是:dcab(填序号).
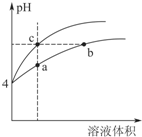
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线如图4,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列
各量一定变小的是bd.
a.c(OH-) b. c(H+)
c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.12mol•L-1 mol•L-1
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw=10-13mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=12.
 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因HCO3-+H2O?H2CO3+OH-.
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液.
其pH由大到小的顺序是:dcab(填序号).
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线如图4,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列
各量一定变小的是bd.
a.c(OH-) b. c(H+)
c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | 氢氧化钠溶液的浓度 (mol•L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23.88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.12mol•L-1 mol•L-1
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw=10-13mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=12.
16. 某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
(1)取一定量的冰醋酸配制250mL 0.5000mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管.
(2)用上述0.5000mol•L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对25.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的浓度为0.2000 mol•L-1.
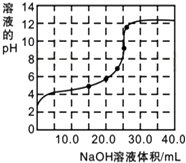
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温下).
①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9.则混合溶液中:水的电离度是纯水的100倍;
c(OH-)-c(CH3COOH)=10-9mol•L-1.
 某研究性学习小组探究醋酸的溶液情况,进行了如下实验.
某研究性学习小组探究醋酸的溶液情况,进行了如下实验.(1)取一定量的冰醋酸配制250mL 0.5000mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管.
(2)用上述0.5000mol•L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对25.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温下).
①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9.则混合溶液中:水的电离度是纯水的100倍;
c(OH-)-c(CH3COOH)=10-9mol•L-1.
3.电子层数相同的三种元素X、Y、Z它们的气态氢化物稳定性顺序为HX>H2Y>H3Z,下列判断错误的是( )
| A. | 离子半径X>Y>Z | |
| B. | 元素原子得电子能力X>Y>Z | |
| C. | 最高价氧化物对应水化物的酸性强弱X>Y>Z | |
| D. | 单质与氢气反应,X、Y、Z难度依次增大 |
13.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( )
①天然气 ②核能 ③石油 ④太阳能 ⑤风能 ⑥氢能.
①天然气 ②核能 ③石油 ④太阳能 ⑤风能 ⑥氢能.
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑤ | D. | ②④⑥ |
20.常温时,将氢氟酸与NaOH溶液混合,所得溶液的pH=7,则此溶液中( )
| A. | c(Na+)>c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(Na+)=c(F-) | D. | 无法确定c(Na+)和c(F-)的大小关系 |
17.某实验小组为测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量wg样品进行实验,下列实验方法所对应的实验方案和测量数据最合理的是( )
| 实验方法 | 实验方案 | 测量数据 | |
| A | 滴定法 | 将样品配成100mL溶液,取10.00mL,加人甲基橙,用标准盐酸滴定 | 消耗盐酸的体积 |
| B | 量气法 | 将样品与盐酸反应,使生成的气体全部被碱石灰吸收 | 碱石灰增重 |
| C | 重量法 | 将样品放人烧杯中,置于天平上,加入足量盐酸 | 减轻的质量 |
| D | 量气法 | 将样品与盐酸反应,气体通过排水量气装置量气 | 排水体积 |
| A. | A | B. | B | C. | C | D. | D |
18.X原子的最外层电子的排布为ns2np5,则X的氢化物的化学式是( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |