题目内容
3.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: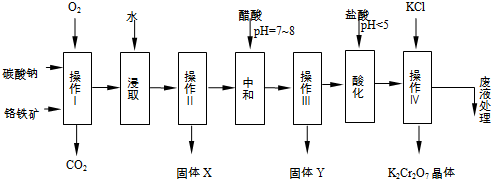
已知:
①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有Fe2O3、MgO(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是Cr2O72-+H2O═2CrO42-+2H+.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).(文字说明)
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
分析 铬铁矿通过焙烧4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑,Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解经操作Ⅱ得固体X为:Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的PH,使偏铝酸盐完全沉淀,操作Ⅲ得到Y为氢氧化铝,继续调节溶液的PH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,生成溶解度极小的K2Cr2O7,结晶得到晶体.
(1)根据影响化学反应速率的因素进行判断;
(2)依据流程图和题干反应分析判断固体X中主要含有Fe2O3、MgO;
(3)结合流程图和反应过程中得到物质分析,酸化步骤用醋酸调节溶液pH<5为了转化CrO42-离子为Cr2O72-;
(4)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤步骤分析回答;
(5)依据物质溶解度比较分析,反应向溶解度小的方向进行;
(6)利用氢氧化铝是两性氢氧化物和强碱反应溶解,少量镁、铁的难溶化合物不溶解;分离提取溶液中的偏铝酸钠可以根据实验室制取氢氧化铝沉淀的方法进行,通入二氧化碳得到氢氧化铝沉淀;灼烧后得到氧化铝,依据元素守恒计算得到.
解答 解:(1)A.升高温度,可以加快反应速率,故A正确;
B.通入过量的空气,增大了氧气的量,可以加快反应速率,故B正确;
C.将原料粉碎,增大了接触面积,可以加快反应速率,故C正确;
D.纯碱是固体,不涉及浓度问题,所以改变纯碱的量,不能改变反应速率,故D错误;
故答案为:ABC;
(2)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑;Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑;Cr2O72-+H2O?2CrO42-+2H+,操作Ⅰ是过滤得到固体X为Fe2O3、MgO,
故答案为:Fe2O3、MgO;
(3)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72-+H2O?2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,
故答案为:Cr2O72-+H2O═2CrO42-+2H+;
(4)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:冷却结晶;过滤;
(5)依据图表物质的溶解度分析对比,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl;说明K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小),
故答案为:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小);
(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是先利用氢氧化铝的两性,用氢氧化钠溶液溶解氢氧化铝过滤得到滤液中通入二氧化碳生成氢氧化铝沉淀,灼烧干燥得到氧化铝干燥固体m g,依据铝元素守恒计算,样品中氢氧化铝的质量分数=$\frac{\frac{m}{102g/mol}×2×78g/mol}{ng}$×100%=$\frac{26m}{17n}$,
故答案为:NaOH溶液;通入过量二氧化碳;$\frac{26m}{17n}$.
点评 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度中等.


| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 任何状况下,78克过氧化钠的分子数为NA | |
| B. | 标况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标况下,22.4L水中含水分子为NA | |
| D. | 含NA个Na+的Na2O溶解于水配成1L溶液中,Na+的物质的量浓度为1mol•L-1 |
| A. | 1.0 | B. | 1.35 | C. | 1.5 | D. | 2.0 |
| A. | 制皂 | B. | 造纸 | C. | 精炼石油 | D. | 制食盐 |
| A. | Na+、K+、Br-、NO3- | B. | K+、NH+4、CO32-、Br- | ||
| C. | Fe2+、Na+、MnO4-、Cl- | D. | Cu2+、Na+、Cl-、SO42- |