题目内容
18.将amol NaHCO3和bmol Na2O2固体混合后,在密闭容器中加热到250℃,让其充分反应.当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,$\frac{a}{b}$的值可能为( )| A. | 1.0 | B. | 1.35 | C. | 1.5 | D. | 2.0 |
分析 混合物在密闭容器中加热到250℃时,可能发生如下反应:
①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑
②2Na2O2+2CO2=2Na2CO3+O2
③2Na2O2+2H2O=4NaOH+O2
④2NaOH+CO2=Na2CO3+H2O?
反应生成气体产物是O2和H2O(g),
根据方程式,从质量守恒的角度计算.
解答 解:混合物在密闭容器中加热到250℃时,可能发生如下反应:
①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑
②2Na2O2+2CO2=2Na2CO3+O2
③2Na2O2+2H2O=4NaOH+O2
④2NaOH+CO2=Na2CO3+H2O?
反应生成气体产物是O2和H2O(g),
由题意可知,残余的固体为Na2CO3和NaOH,生成的气体为O2和H2O(g),则有总反应式为aNaHCO3+bNa2O2=aNa2CO3+(2b-a)NaOH+(a-b)H2O+$\frac{b}{2}$O2,
所以 2b-a>0,$\frac{b}{a}$>1/2,b-a>0?$\frac{b}{a}$<1,故$\frac{a}{b}$的数值范围:1<$\frac{a}{b}$<2,
故选BC.
点评 本题考查混合物的有关计算,为高频考点,根据反应方程式结合原子守恒进行计算,侧重考查学生分析计算能力,题目难度中等.

练习册系列答案
相关题目
8.下列溶剂中,最能溶解离子型溶质的是( )
| A. | CCl4 | B. | CH3OH | C. | C5H12 | D. | (C2H5)2O |
13.部分共价键的键长和键能的数据如表,则以下推理肯定错误的是( )
| 共价键 | C-C | C=C | C≡C |
| 键长(nm) | 0.154 | 0.134 | 0.120 |
| 键能(kJ/mol) | 347 | 612 | 838 |
| A. | 0.154 nm>苯中碳碳键键长>0.134nm | |
| B. | C=O键键能>C-O键键能 | |
| C. | 乙烯的沸点高于乙烷 | |
| D. | 烯烃比炔烃更易与溴加成 |
3.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
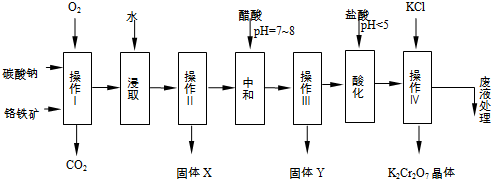
已知:
①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有Fe2O3、MgO(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是Cr2O72-+H2O═2CrO42-+2H+.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).(文字说明)
(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入过量二氧化碳(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).

已知:
①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有Fe2O3、MgO(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是Cr2O72-+H2O═2CrO42-+2H+.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).(文字说明)
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
10.下列各组物质反应后,溶液的导电性比反应前明显增加的是(忽略溶液体积变化)( )
| A. | 向0.1mol/L NaOH溶液滴加醋酸 | |
| B. | 向氢硫酸饱和溶液中通入氯气 | |
| C. | 向氯化铜溶液中加入适量氢氧化钡溶液 | |
| D. | 向硝酸银溶液通入氯化氢气体 |
7.下列有关化学反应过程或实验现象的解释中,正确的是( )
| A. | 向某无色溶液中加入BaCl2,产生白色浑浊说明该溶液中一定有SO42- | |
| B. | 向淀粉碘化钾溶液中加氯水,溶液变为蓝色说明氯气的氧化性强于碘单质 | |
| C. | 硫酸能与NaCl反应生成HCl,说明硫酸的酸性比盐酸强 | |
| D. | 向某溶液中滴加稀盐酸无明显现象,再加硝酸银产生白色沉淀,说明溶液中含Cl- |
8.生活中碰到的某些问题和物质,常涉及到化学知识,下列分析不正确的是( )
| A. | 维生素A: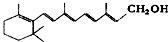 它是一种难溶于水的醇 它是一种难溶于水的醇 | |
| B. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 | |
| C. | 某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2 | |
| D. | 金属材料都是导体,非金属材料不都是绝缘体 |