题目内容
13.如下图,利用培养皿探究SO2的性质.实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面.下表中对实验现象的描述或所做的解释不正确的是( )
| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 向Na2SO3固体上滴几滴浓硫酸反应生成二氧化硫气体,二氧化硫不与氯化钡反应,SO2与Na2S溶液反应产生了S单质,二氧化硫具有还原性含有高锰酸钾溶液褪色,二氧化硫气体使品红溶液褪色;据此分析.
解答 解:向Na2SO3固体上滴几滴浓硫酸反应生成二氧化硫气体,依据二氧化硫的性质判断;
A、二氧化硫不与氯化钡反应,不能生成BaSO3沉淀;故A错误;
B、SO2与Na2S溶液反应,发生氧化还原反应产生了S单质;故B正确;
C、二氧化硫具有还原性能使高锰酸钾溶液褪色,表现二氧化硫的还原性;故C正确;
D、向Na2SO3固体上滴几滴浓硫酸反应生成二氧化硫气体,二氧化硫气体使品红溶液褪色,证明二氧化硫的漂白性,故D正确;
故选A.
点评 本题考查了二氧化硫的性质分析判断,注意反应现象的分析和性质的应用是解题关键,题目难度不大,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
相关题目
3.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成.将该粉末与足量的盐酸反应有气体X逸出,X气体能被氢氧化钠溶液完全吸收.若将该粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原粉末的质量.下列判断正确的是( )
| A. | 粉末中一定有Na2O、Na2O2、NaHCO3 | |
| B. | 粉末中一定不含有Na2CO3和NaCl | |
| C. | 粉末中一定含有Na2O和NaHCO3 | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaCl |
8.下列溶剂中,最能溶解离子型溶质的是( )
| A. | CCl4 | B. | CH3OH | C. | C5H12 | D. | (C2H5)2O |
18.化学变化在我们生活中处处可见,利用家庭生活用品不能够完成的探究性实验是( )
| A. | 检验自来水中含有Cl- | B. | 检验鸡蛋壳中含有碳酸盐 | ||
| C. | 检验加碘食盐中加的不是碘单质 | D. | 除去热水瓶中的水垢 |
5.常温下,向饱和澄清石灰水中加入少量CaO固体,充分反应后恢复到原来的温度,所得溶液中( )
| A. | c(Ca2+)、c(OH-)均增 | B. | c(Ca2+)、c(OH-)均保持不变 | ||
| C. | c(Ca2+)、c(OH-)均减小 | D. | 溶液质量增大 |
2.下列关于碱金属的说法中,正确的是( )
| A. | 碱金属单质的密度都比水小 | |
| B. | 碱金属单质都是还原剂 | |
| C. | 碱金属单质的熔沸点一般随着原子的电子层数的增多而升高 | |
| D. | 碱金属单质在氧气中燃烧,产物都是过氧化物 |
3.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
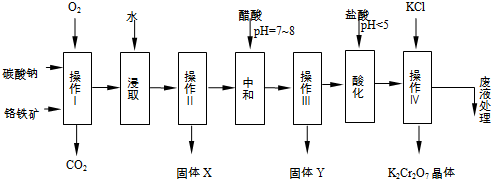
已知:
①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有Fe2O3、MgO(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是Cr2O72-+H2O═2CrO42-+2H+.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).(文字说明)
(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入过量二氧化碳(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).

已知:
①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有Fe2O3、MgO(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是Cr2O72-+H2O═2CrO42-+2H+.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).(文字说明)
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |