题目内容
15.计算O.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl-的数目之比.分析 先根据溶液中物质的量n=c×V计算出氯化钾以及氯化铁的物质的量,然后依据1mol中氯化铁中含有3mol氯离子计算氯离子的物质的量,然后求比值.
解答 解:O.5L 1mol/L FeCl3溶液,氯化铁的物质的量n=c×V=0.5L×1mol/L=0.5mol,所以氯离子的物质的量为0.5mol×3=1.5mol;
0.2L 1mol/L KCl溶液,氯化钾的物质的量=氯离子的物质的量=0.2L×1mol/L=0.2mol,故两溶液中氯离子的数目之比等于物质的量之比=1.5:0.2=15:2,
答:数目比为15:2.
点评 本题主要考查的是物质的量的有关计算,熟练掌握公式n=c×V是解决本题的关键,还要清楚物质中各种微粒的多少.

练习册系列答案
相关题目
5.常温下,向饱和澄清石灰水中加入少量CaO固体,充分反应后恢复到原来的温度,所得溶液中( )
| A. | c(Ca2+)、c(OH-)均增 | B. | c(Ca2+)、c(OH-)均保持不变 | ||
| C. | c(Ca2+)、c(OH-)均减小 | D. | 溶液质量增大 |
3.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
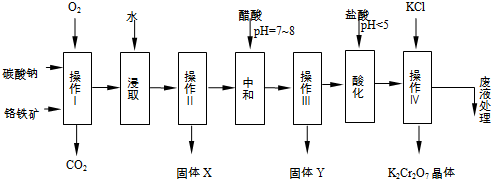
已知:
①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有Fe2O3、MgO(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是Cr2O72-+H2O═2CrO42-+2H+.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).(文字说明)
(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入过量二氧化碳(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).

已知:
①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{一定条件}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{一定条件}{→}$2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有Fe2O3、MgO(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是Cr2O72-+H2O═2CrO42-+2H+.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).(文字说明)
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
10.下列各组物质反应后,溶液的导电性比反应前明显增加的是(忽略溶液体积变化)( )
| A. | 向0.1mol/L NaOH溶液滴加醋酸 | |
| B. | 向氢硫酸饱和溶液中通入氯气 | |
| C. | 向氯化铜溶液中加入适量氢氧化钡溶液 | |
| D. | 向硝酸银溶液通入氯化氢气体 |
20.下列说法错误的是( )
| A. | 新制氯水只含Cl2和H2O两种分子 | B. | 氢氟酸不能贮放在玻璃瓶里 | ||
| C. | 光导纤维的主要成分是二氧化硅 | D. | 浓硫酸用铁制容器密封保存 |
7.下列有关化学反应过程或实验现象的解释中,正确的是( )
| A. | 向某无色溶液中加入BaCl2,产生白色浑浊说明该溶液中一定有SO42- | |
| B. | 向淀粉碘化钾溶液中加氯水,溶液变为蓝色说明氯气的氧化性强于碘单质 | |
| C. | 硫酸能与NaCl反应生成HCl,说明硫酸的酸性比盐酸强 | |
| D. | 向某溶液中滴加稀盐酸无明显现象,再加硝酸银产生白色沉淀,说明溶液中含Cl- |
4.用惰性电极电解下列溶液一段时间再加入一定量的另一纯净物(方括号内),能使溶液恢复原来的成分和浓度的是( )
| A. | CuSO4[Cu(OH)2] | B. | NaOH[NaOH] | C. | CuCl2[CuCl2] | D. | NaCl[NaCl] |
5.下列变化需加氧化剂才能实现的是( )
| A. | NH3→NH4+ | B. | N2→NH3 | C. | NH3→NO | D. | Cl2→Cl- |