题目内容
18.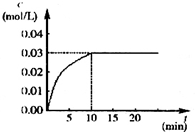 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:(1)根据上图数据,反应开始至达到平衡时,CO2的化学反应速率为v(CO2)=0.03mol/(L•min);反应达平衡时,c(H2O)=0.01 mol/L,该温度下的平衡常数K=9.
(2)判断该反应达到平衡的依据是②④.
①正、逆反应速率都为零
②CO减少的化学反应速率和CO2减少的化学反应速率相等
③CO、H2O、CO2、H2的浓度都相等
④CO、H2O、CO2、H2的浓度都不再发生变化
(3)如要一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,在相同的条件下,反应达平衡时,c(H2)=0.03mol/L.
分析 (1)根据v=$\frac{△c}{△t}$计算二氧化碳的反应速率,根据三段式计算平衡时各物质的浓度,再根据化学平衡常数概念带入浓度计算化学平衡常数k;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变以及由此引起的一系列物理量不变;
(3)如果一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,与开始时加入0.3mol CO和0.3mol H2O为等效平衡,所以平衡时c(H2)相同.
解答 解:(1)根据v=$\frac{△c}{△t}$=$\frac{0.03mol/L-0}{10min}$=0.003mol/(L•min);由图知道平衡时二氧化碳的浓度为0.03mol/L,则反应消耗H2O的浓度0.03mol/L,平衡时H2O的浓度为:$\frac{0.2mol}{5L}$-0.03mol/L=0.01mol/L;
根据三段式:CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L)0.04 0.04 0 0
转化量(mol/L)0.03 0.03 0.03 0.03
平衡量(mol/L)0.01 0.01 0.03 0.03
则平衡常数k=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.03×0.03}{0.01×0.01}$=9,
故答案为:0.03; 0.01; 9;
(2)①正、逆反应速率都为零,该反应没有开始,所以一定没有达到平衡状态,故错误;
②CO减小的化学反应速率和CO2减小的化学反应速率相等,正逆反应速率相等,该反应达到平衡状态,故正确;
③CO、H2O、CO2、H2的浓度都相等,该反应不一定达到平衡状态,与反应物初始浓度及转化率有关,故错误;
④CO、H2O、CO2、H2的浓度都不再发生变化,该反应正逆反应速率相等,达到平衡状态,故正确.
故答案为:②④;
(3)如果一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,与开始时加入0.3mol CO和0.3mol H2O为等效平衡,则两种条件下,达到平衡状态时其H2的物质的量浓度相等,所以达到平衡状态时,c(H2)=0.03mol/L.
故答案为:0.03.
点评 本题考查化学平衡影响因素、反应方向判断、化学平衡常数计算、等效平衡等知识点,为高频考点,侧重考查学生分析计算能力,题目难度不大.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0016mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,达到平衡时,PCl3的转化率小于80% |
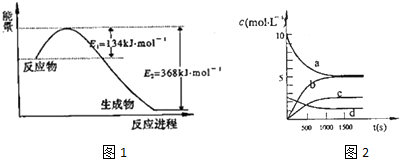
(1)图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是c,用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol•L-1•s-1.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序为HNO3>H2CO3>H2SiO3
(3)⑦⑧⑨的第一电离能由小到大的顺序为Si<S<P
(4)比较④和⑨的氢化物的稳定性大小H2O>H2S,沸点高低H2O>H2S
(5)写出元素⑩的+1价含氧酸的结构式H-O-Cl.
| A. | 纤维素 | B. | 淀粉 | C. | 葡萄糖 | D. | 蛋白质 |
| A. | x:y=3:1 | B. | v(A):v(C)=2:1 | ||
| C. | A的平衡浓度为0.4mol/L | D. | A与B的平衡浓度之比为3:2 |
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍、四种溶液的pH:①>②>④>③ | |
| B. | 温度下降10℃,四种溶液的pH均不变 | |
| C. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c(Cl-)<c(NH4+)<c(H+)<c(OH-) |