题目内容
9.(1)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序(用序号填空):④>①>②>③.(2)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)=2LiH(s)△H=-182kJ•mol-1
②2H2(g)+O2(g)═2H2O(1)△H=-572kJ•mol-1;
③4Li(s)+O2(g)═2Li2O(s)△H=-1196kJ•mol-1
试写出LiH在O2中燃烧的热化学方程式2LiH(s)+O2(g)═Li2O(S)+H2O(l)△H=-702 kJ•mol.
(3)2Al+Fe2O3$\underline{\underline{高温}}$2Fe+Al2O3反应的△S=0(选填“>”“<”或“=”),在高温下,该反应能自发进行(填“能”或“不能”自发进行).
分析 (1)酸或碱都抑制水电离,能水解的盐促进水解,不水解的盐对水的电离无影响,依此进行判断;
(2)依据选项中提供的反应信息判断,LiH燃烧是和氧气反应生成产物为Li2O(S)+H2O(l),结合热化学方程式和盖斯定律,通过合并热化学方程式得到所求的热化学方程式,注意热化学方程式改变系数,焓变随之改变;
(3)根据该反应的物质种类和状态均不变来分析.
解答 解:(1)酸或碱都抑制水电离,故②NaOH和③H2SO4溶液中水的电离程度较小,由于硫酸是二元强酸,氢氧化钠是一元强碱,故相同物质的量浓度的硫酸中水的电离程度小于氢氧化钠中水的电离程度;能水解的盐促进水解,故④(NH4)2SO4溶液中水的电离程度最大;不水解的盐①NaCl对水的电离无影响,
故水的电离程度的正确排列顺序为:④>①>②>③.
故答案为:④>①>②>③;
(2)①2Li(S)+H2(g)═2LiH(s)△H=-182kJ•mol-1;
②2H2(g)+O2(g)═2H2O(1)△H=-572kJ•mol-1;
③4Li(s)+O2(g)═2Li2O(s)△H=-1196kJ•mol-1,
依据热化学方程式结合盖斯定律③-①×2+③得到:
4LiH(s)+2O2(g)=2Li2O(s)+2H2O(l)△H=-14O4KJ/mol,
即热化学方程式为2LiH(s)+O2(g)═Li2O(S)+H2O(l)△H=-702 kJ•mol;
故答案为:2LiH(s)+O2(g)═Li2O(S)+H2O(l)△H=-702 kJ•mol;
(3)由于该反应的物质种类和状态均不变,故该反应是熵变△S=0的反应,该反应在高温下能自发进行,故答案为:=,能自发进行.
点评 本题考查了酸碱盐对水的电离的影响和盖斯定律的运用,难度不大,应注意的是酸和碱均抑制水的电离,盐的水解促进水的电离.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 1molC质量是12 g•mol-1 | |
| B. | 22.4L H2的物质的量是1mol | |
| C. | 将60gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度是1.5mol•L-1 | |
| D. | NaCl的摩尔质量是58.5 g•mol-1 |
A.煤炭制氢气,相关反应为:
C(s)+H2O(g)?CO(g)+H2(g),△H=a kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g),△H=b kJ•mol-1
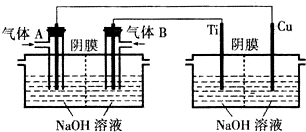
B.氯碱工业中电解饱和食盐水制备氢气.
C.硫铁矿(FeS2)燃烧产生的SO2通过如图碘循环工艺过程制备H2:

回答问题:
(1)某温度(T1)下,向容积为2L的密闭容器中充入一定量的CO和H2O,发生煤炭制氢气的一个反应:反应过程中测定的部分数据如表(表中t1<t2):
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
保持其他条件不变,温度由T1升至T2,上述反应平衡常数为0.64,则正反应为放热(吸热、放热)反应.
保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时,n(CO2)=0.40 mol.
(2)写出方法B制备氢气的离子方程式;2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑
(3)膜反应器常利用膜的特殊功能实现反应产物的选择性分离.方法C在HI分解反应中使用膜反应器分离出H2的目的是减小氢气的浓度,使HI分解平衡正向移动,提高HI的分解率.
(4)反应:C(s)+CO2(g)=2CO(g),△H=(a-b)kJ•mol-1.
(5)某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为:2CO2+4e-+2H2O=2CO+4OH-.

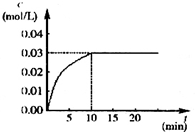 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图: 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.