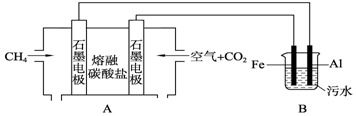
题目内容
8.现有常温下的四种溶液(如表),下列有关叙述中正确的是( )| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍、四种溶液的pH:①>②>④>③ | |
| B. | 温度下降10℃,四种溶液的pH均不变 | |
| C. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c(Cl-)<c(NH4+)<c(H+)<c(OH-) |
分析 A、从加水促进弱电解质的电离的角度分析;
B、弱电解质的电离是吸热过程,温度降低,可以抑制弱电解质的电离,且水的离子积减小;
C、弱电解质的电离平衡影响因素分析判断;
D、酸碱反应和弱电解质的电离平衡分析比较.
解答 解:A、①氨水pH=11,平衡状态下氢氧根离子浓度为10-3mol/L;②氢氧化钠pH=11,氢氧根离子浓度为10-3mol/L;③醋酸pH=3,平衡状态下氢离子浓度为10-3mol/L;④硫酸pH=3,溶液中氢离子浓度为10-3mol/L;分别加水稀释10倍、四种溶液的pH大小为,碱比酸的pH大,弱碱弱酸存在电离平衡,加水稀释比强酸强碱的pH变化小,所以得到①>②>④>③,故A正确;
B、降低温度,抑制弱电解质电离,所以水的离子积常数、醋酸和一水合氨的电离程度都减小,则氨水和氢氧化钠溶液的pH都减小,故B错误;
C、在①、②中分别加入适量的氯化铵晶体后,①中溶解形成的铵根对弱电解质的电离平衡起到了抑制作用,氢氧根离子浓度减小,pH减小;②中溶解的铵根离子与氢氧化钠溶液中的氢氧根离子会结合成弱电解质一水合氨,减小氢氧根离子的浓度,pH减小,故C错误;
D、将①氨水PH=11,平衡状态下氢氧根离子浓度为10-3mol/L④盐酸PH=3,溶液中氢离子浓度为10-3mol/L两种溶液等体积混合,氨水中平衡状态下的氢氧根离子与盐酸中的氢离子恰好反应,氨水又电离出氢氧根离子和铵根离子,则c(OH-)>c(H+),综上所述可知溶液中的离子浓度大小c(NH+4)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选A.
点评 本题考查了影响弱电解质的电离平衡的因素,酸碱混合时的定性分析和定量计算,pH的计算应用,溶液稀释时的pH变化判断,反应后溶液中的离子浓度大小判断,综合性较强,题目难度中等.

| A. | 钾元素化合价降低 | B. | Fe(OH)3发生氧化反应 | ||
| C. | 该反应是置换反应 | D. | Cl2是还原剂 |

| A. | 浓硝酸与浓氨水 | B. | 浓硫酸与浓氨水 | ||
| C. | 浓盐酸与浓氯化铵溶液 | D. | 浓硝酸与浓氢氧化钠溶液 |
| A. | Ba(OH)2 和盐酸;Ba(OH)2和 H2SO4 | |
| B. | BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 | |
| C. | Ca(OH)2溶液通过量CO2; NaOH溶液通过量CO2 | |
| D. | Ba(OH)2和 HNO3; Cu (OH)2和 H2SO4 |
| A. | 标准状况下,11.2 L SO2和SO3的混合物中硫原子数为0.5NA | |
| B. | 1 mol N2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA | |
| D. | 常温常压下,7.8 g Na2O2含有的阴离子数目为0.1NA |
(1)以甲烷为原料可制得合成氨气用的氢气.图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量变化示意图,写出该反应的热化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1)kJ/mol(△H用E1、E2、E3表示).
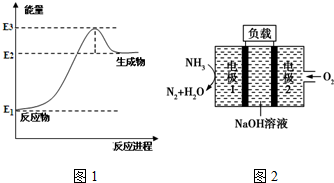
(2)已知合成氨反应的平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.68 | 0.5 |
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(3)①在25℃下,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$;
②向25mL 0.10mol•L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是d(填字母序号).
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图2所示,电极1发生的电极反应式为2NH3+6OH--6e-=N2↑+6H2O.
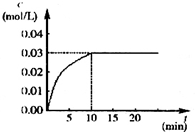 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图: 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.