题目内容
8.温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0016mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,达到平衡时,PCl3的转化率小于80% |
分析 A.由表中数据可知50s内△n(PCl3)=0.16mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(PCl3);
B.由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol,可知升高温度平衡向正反应方向移动;
C.先求平衡常数K,再求浓度商(Qc),若K>Qc,说明平衡向正反应方向移动,若K<Qc,说明平衡向逆反应方向移动,若K=Qc,说明平衡不移动,据此判断平衡移动,进而判断达到平衡前v(正)、v(逆)关系;
D.等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,据此计算判断.
解答 解:A.由表中数据可知,50s内△n(PCl3)=0.16mol,反应在前50 s的平均速率为:v(PCl3)=$\frac{\frac{0.16mol}{2L}}{50s}$=0.0016mol/(L•s),故A正确;
B.由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.11 mol/L×2L=0.22mol,说明升高温度平衡正向移动,正反应为吸热反应,其△H>0,故B正确;
C.对于可逆反应:PCl5(g)?PCl3(g)+Cl2(g),
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
所以平衡常数K=$\frac{0.1×0.1}{0.4}$=0.025.
起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=$\frac{0.1×0.1}{0.5}$=0.02,Qc<K,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C正确;
D.等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,则达到平衡时PCl3的转化率大于$\frac{1.6mol}{2mol}$=80%,故D错误;
故选D.
点评 本题考查化学平衡的计算,题目难度中等,涉及反应速率、平衡常数计算、平衡移动、等效平衡等知识,明确三段式在化学平衡计算中的应用为解答关键,注意D中使用等效平衡思想分析,可使问题简单化,试题培养了学生的分析能力及化学计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | Al3++4OH-→[Al(OH)4]- | B. | Al2O3+2OH-+3H2O=2[Al(OH)4]- | ||
| C. | CO2+2OH-=CO32-+H2O | D. | 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ |
| A. | 1molC质量是12 g•mol-1 | |
| B. | 22.4L H2的物质的量是1mol | |
| C. | 将60gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度是1.5mol•L-1 | |
| D. | NaCl的摩尔质量是58.5 g•mol-1 |
| A. | 1.8×10-7 mol•L-1,2 | B. | 1×10-7 mol•L-1,2 | ||
| C. | 1.8×10-7 mol•L-1,3 | D. | 1×10-7 mol•L-1,3 |
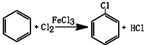
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压,冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙;
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.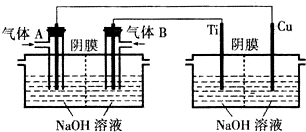
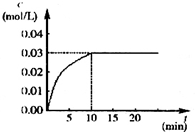 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图: