题目内容
13.某兴趣小组在实验室用铜和硫酸为原料多种方法制取硫酸铜.制备方法如下.方法一:
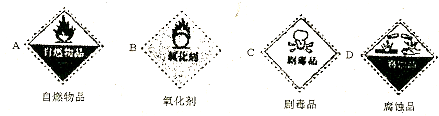
(1)浓硫酸试剂瓶上适合贴上的标签是D (填“序号”).
(2)甲同学取6.4g铜片和10mL l8mol•L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后得到蓝色溶液和刺激性气味的气体,同时发现在试管底部有一些灰白色固体.
①铜跟浓硫酸反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②直到最后反应完毕,发现试管中还有铜片剩余.甲根据所学的化学知识,认为反应后溶液中还有硫酸剩余.他这样认为的理由是加热条件下,Cu和浓硫酸反应但和稀硫酸不反应.
请你设计一个简单的实验证明反应后溶液中硫酸的存在:取反应后溶液少许于试管中,加入紫色石蕊试液,如果溶液变红色,说明含有氢离子,则含有稀硫酸
③甲同学为了验证其中灰白色固体的主要成分.设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,充分振荡.
实验现象:溶液变蓝色;
实验结论:所得白色固体的化学式为CuSO4.
方法二:
(3)乙同学认为甲设计的实验方案不好,他自己设计的思路是:先将铜粉在空气中灼烧转化成氧化铜,再将氧化铜溶解于稀硫酸.对比甲的方案,你认为乙同学方案的优点是
①不产生污染环境的气体,②硫酸用量少.
(4)丙同学在一个烧杯中加入铜粉,倒入稀硫酸,在加入双氧水,发现溶液变蓝色,请写出所发生反应的离子方程式Cu+H2O2+H+=Cu2++2H2O.
(5)从硫酸铜稀溶液得到蓝矾的实验操作步骤是:蒸发浓缩、冷却结晶、过滤.
分析 (1)浓硫酸具有强腐蚀性;
(2)①加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水;
②加热条件下,Cu和浓硫酸反应,但和稀硫酸不反应;
酸能使紫色石蕊试液变红色;
③硫酸铜粉末为白色,而硫酸铜溶液为蓝色;
(3)Cu和氧气反应生成CuO,CuO和稀硫酸反应生成硫酸铜和水;
(4)酸性条件下,Cu和稀硫酸反应生成硫酸铜和水;
(5)将硫酸铜溶液中获取胆矾需要的实验操作是蒸发浓缩、冷却结晶、过滤.
解答 解:(1)浓硫酸具有强腐蚀性,所以其标签应该是D,故答案为:D;
(2)①加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②加热条件下,Cu和浓硫酸反应,但和稀硫酸不反应,所以反应后的溶液中还含有硫酸;
酸能使紫色石蕊试液变红色,硫酸根离子用盐酸酸化的氯化钡溶液检验,其检验方法为:取反应后溶液少许于试管中,加入紫色石蕊试液,如果溶液变红色,说明含有氢离子,则含有稀硫酸;
故答案为:加热条件下,Cu和浓硫酸反应但和稀硫酸不反应;取反应后溶液少许于试管中,加入紫色石蕊试液,如果溶液变红色,说明含有氢离子,则含有稀硫酸;
③硫酸铜粉末为白色,而硫酸铜溶液为蓝色,将白色固体溶于水后,溶液变蓝色,说明白色固体为CuSO4,
故答案为:CuSO4;
(3)由2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4=CuSO4+H2O可知,不生成有毒气体二氧化硫,且使用的硫酸量少,则其优点为不产生污染环境的气体、硫酸用量少,故答案为:不产生污染环境的气体;硫酸用量少;
(4)酸性条件下,Cu和稀硫酸反应生成硫酸铜和水,离子方程式为Cu+H2O2+H+=Cu2++2H2O,
故答案为:Cu+H2O2+H+=Cu2++2H2O;
(5)将硫酸铜溶液中获取胆矾需要的实验操作是蒸发浓缩、冷却结晶、过滤,
故答案为:蒸发浓缩;冷却结晶;过滤.
点评 本题以Cu和浓硫酸反应为载体考查物质制备及化学实验方案评价,为高频考点,侧重考查学生实验操作、实验评价及分析判断能力,明确化学反应原理及实验评价方法是解本题关键,化学实验要考虑环境保护、药品用量、实验操作的可行性等方面,题目难度不大.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案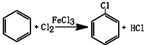
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压,冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙;
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
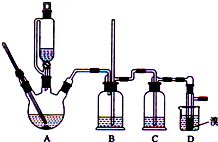
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是D;(填正确选项前的字母)
A.引发反应 B.加快反应速度 C.防止乙醇挥发 D.减少副产物乙醚生成
(2)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
A.水 B.浓硫酸 C.氢氧化钠溶液 D.饱和碳酸氢钠溶液
(3)判断该制备实验中各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗(填仪器名)中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用B洗涤除去;(填正确选项前的字母)
A.水 B.氢氧化钠溶液 C.碘化钠溶液 D.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却,避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. | Fe2(SO4)3溶液在空气中加热蒸干并灼烧后,可以得到Fe2(SO4)3 | |
| B. | 为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下,加入氨水,过滤后向滤液中再加入适量盐酸 | |
| C. | 配制FeSO4溶液时,为了抑制亚铁离子水解,需加入少量Fe | |
| D. | 室温下,向PH=4的醋酸溶液中加入等体积的PH=10的NaOH溶液,反应后溶液呈碱性,是因为生成了强碱弱酸盐 |

| A. | 浓硝酸与浓氨水 | B. | 浓硫酸与浓氨水 | ||
| C. | 浓盐酸与浓氯化铵溶液 | D. | 浓硝酸与浓氢氧化钠溶液 |

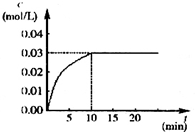 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图: