题目内容
3. 有A、B、C、D四种短周期元素,它们在周期表中的位置如图所示,已知四种元素核外共有56个电子,则以下说法不正确的是( )
有A、B、C、D四种短周期元素,它们在周期表中的位置如图所示,已知四种元素核外共有56个电子,则以下说法不正确的是( )| A. | A的氢化物在常温下通常为液态 | |
| B. | A的单质与C的某种化合物之间可能发生置换反应 | |
| C. | B、C、D的含氧酸酸性依次增强 | |
| D. | D的单质是制备漂白剂的重要原料 |
分析 A、B、C、D五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl,以此解答该题.
解答 解:A、B、C、D五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl,
A.A为O元素,其氢化物为水,常温下水为液态,故A正确;
B.A单质为氧气,C为S元素,氧气能够与硫化氢反应生成S单质和水,该反应为置换反应,故B正确;
C.B为P、C为S、D为Cl,三种的非金属性逐渐减弱,则三种的最高价含氧酸的酸性逐渐减弱,没有告诉最高价,则无法判断三种含氧酸的酸性强弱,故C错误;
D.D为Cl元素,其单质为氯气,氯气是制备漂白剂的重要原料,故D正确;
故选C.
点评 本题考查了原子结构与元素周期律的综合应用,题目难度中等,正确推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,混合溶液的pH最接近于( )
| A. | 8.3 | B. | 8.7 | C. | 9.3 | D. | 9.7 |
11.某化合物的结构(键线式)图1及球棍模型如图2如下:

该有机分子的核磁共振氢谱图如图3下(单位是ppm)下列关于该有机物的叙述,不正确的是( )

该有机分子的核磁共振氢谱图如图3下(单位是ppm)下列关于该有机物的叙述,不正确的是( )
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH2CH3 | |
| D. | 1 mol 该有机物完全燃烧可以产生 6 mol水 |
18.下表中的数据表示破坏1mol化学键需消耗的能量:根据下表数据计算以下反应生成1mol CO2时的热量变化( )
CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(g)
CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(g)
| 化 学 键 | C-H | O-O | O=O | C-O | C=O | H-O |
| 能量 (kJ) | 415 | 138 | 498 | 343 | 798 | 465 |
| A. | 放出热量800 kJ | B. | 放出热量1520 kJ | C. | 吸收热量110 kJ | D. | 放出热量610 kJ |
8.已知723K时,2S02(g)+02(g)?2S02(g)△H=-Q,在相同条件下,向一密闭容器中通入2molS02和1mol02,达到平衡时放出的热量为Q1;向另一体积相同的密闭容器中通入1molS02和0.5mol02,达到平衡时放出的热量为Q2.则Q1、Q2、Q满足的关系是( )
| A. | Q>Q1>2Q2 | B. | Q2<Q1<2Q2 | C. | Q=Q1>Q2 | D. | Q1=2Q2 |
15.有A、B、C、D、E五种元素,其相关信息如下:
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p6sd104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
13.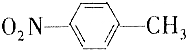 和
和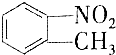 的一些物理性质如下表所示:
的一些物理性质如下表所示:
(1)分离这两种物质的混合物可采用的方法是D(填字母).
A.过滤 B.分液 C.蒸发 D.分馏
(2)实验需要用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、温度计、冷凝管以及锥形瓶.
 和
和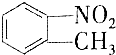 的一些物理性质如下表所示:
的一些物理性质如下表所示:| 物质 | 熔点 | 沸点 | 密度 | 水溶性 |
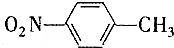 | -10℃ | 212℃ | 1.1622g/cm3 | 不溶于水 |
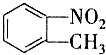 | 54℃ | 238℃ | 1.1581g/cm3 | 不溶于水 |
A.过滤 B.分液 C.蒸发 D.分馏
(2)实验需要用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、温度计、冷凝管以及锥形瓶.
 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
 .
. ,E为
,E为 .
. .
.