题目内容
5.下列化学用语书写正确的是( )| A. | 氯原子的结构示意图  | |
| B. | 溴化钠的电子式: | |
| C. | 氯化镁的电子式: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
分析 A、氯的质子数为17,其最外层电子数为7;
B、溴化钠为离子化合物,由钠离子和溴离子构成;
C、镁最外层2个电子,氯最外层7个电子,形成离子化合物时都满足最外层8电子结构;
D、HCl是共价化合物,电子式中不会存在离子.
解答 解:A、因氯原子结构中最外层电子数为7,故A错误;
B、溴化钠为离子化合物,由钠离子和溴离子构成,电子式为 ,故B错误;
,故B错误;
C、氯化镁为离子化合物,在形成化合物时镁原子失去电子变为镁离子,氯原子等到电子变为氯离子,故C正确;
D、因HCl为共价化合物,则在HCl中的电子式中不会有氢离子和氯离子,故D错误;
故选C.
点评 本题考查化学用语,学生应注意原子的最外层电子数来分析形成的化合物,离子化合物中有离子,共价化合物中一定没有离子.

练习册系列答案
相关题目
15.下列实验操作正确的是( )
| A. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| B. | 稀释浓硫酸时,常把水加入到盛浓硫酸的烧杯中 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 不慎将浓硫酸溅到皮肤上,应先用布拭去再用水冲洗 |
17.化学反应:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1<0
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2<0
C(s)+O2(g)═CO2(g)△H3<0;
下列说法中不正确的是(相同条件下)( )
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2<0
C(s)+O2(g)═CO2(g)△H3<0;
下列说法中不正确的是(相同条件下)( )
| A. | 56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 | |
| B. | 12 g C所具有的能量一定大于28 g CO所具有的能量 | |
| C. | △H1+△H2=△H3 | |
| D. | 将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
14.将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,混合溶液的pH最接近于( )
| A. | 8.3 | B. | 8.7 | C. | 9.3 | D. | 9.7 |
15.有A、B、C、D、E五种元素,其相关信息如下:
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p6sd104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
 、⑨
、⑨ 、⑩
、⑩
 .
. 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.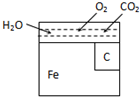 金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.
金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.