题目内容
20.${\;}_{86}^{222}$Rn、${\;}_{86}^{219}$Rn是( )| A. | 两种元素 | B. | 互为同位素 | C. | 同种核素 | D. | 同一原子 |
分析 A.元素的种类由质子数决定;
B.质子数相同中子数不同的同一元素互称同位素;
C.核素的种类由质子数和中子数决定;
D.原子的种类由质子数和中子数决定.
解答 解:${\;}_{86}^{222}$Rn、${\;}_{86}^{219}$Rn是同种元素Rn的不同核素,质子数相同为86,中子数不同,分别为:136、133,互为同位素,
故选B.
点评 本题考查同位素的概念及判断,同位素是指具有相同质子数,不同中子数同一元素的不同核素,即同一元素的不同原子间互为同位素,注意形似概念的区别.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
11.某化合物的结构(键线式)图1及球棍模型如图2如下:
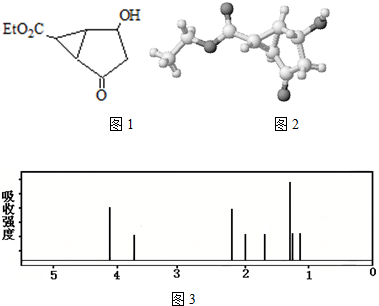
该有机分子的核磁共振氢谱图如图3下(单位是ppm)下列关于该有机物的叙述,不正确的是( )

该有机分子的核磁共振氢谱图如图3下(单位是ppm)下列关于该有机物的叙述,不正确的是( )
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH2CH3 | |
| D. | 1 mol 该有机物完全燃烧可以产生 6 mol水 |
8.已知723K时,2S02(g)+02(g)?2S02(g)△H=-Q,在相同条件下,向一密闭容器中通入2molS02和1mol02,达到平衡时放出的热量为Q1;向另一体积相同的密闭容器中通入1molS02和0.5mol02,达到平衡时放出的热量为Q2.则Q1、Q2、Q满足的关系是( )
| A. | Q>Q1>2Q2 | B. | Q2<Q1<2Q2 | C. | Q=Q1>Q2 | D. | Q1=2Q2 |
15.有A、B、C、D、E五种元素,其相关信息如下:
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p6sd104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
9.某元素原子结构示意图为 ,该原子( )
,该原子( )
 ,该原子( )
,该原子( )| A. | 核电荷数为32 | B. | 核外电子数为16 | C. | 最外层电子数为6 | D. | 核外电子层数为3 |
7.A是一种含碳、氢、氧三种元素的有机化合物.已知:A中碳的质量分数为52.16%,氢的质量分数为13.14%,那么A的实验式是( )
| A. | C2H6O | B. | CH3O | C. | C4H12O2 | D. | C5H10O4 |
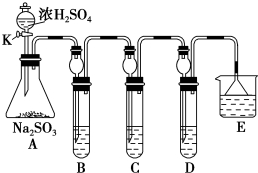
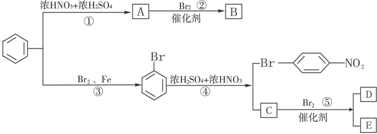
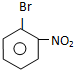 .
. ,E为
,E为 .
. .
.