题目内容
18.在甲酸溶液中加入一定量的NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是( )| A. | c(HCOO-)<c(Na+) | B. | c(HCOO-)>c(Na+) | C. | c(OH-)>c(HCOO-) | D. | c(OH-)<c(HCOO-) |
分析 在甲酸溶液中加入一定量的NaOH溶液,恰好完全反应生成HCOONa,HCOO-在溶液中水解,溶液显碱性,水解程度较小,据此分析.
解答 解:在甲酸溶液中加入一定量的NaOH溶液,恰好完全反应生成HCOONa,HCOO-在溶液中水解,HCOO-的浓度减小,则溶液显碱性c(HCOO-)<c(Na+),水解程度较小,所以溶液中氢氧根离子浓度很小,则c(OH-)<c(HCOO-),故AD正确;
故选AD.
点评 本题考查了盐的水解原理和溶液中离子浓度大小比较,题目难度不大,注意把握盐的水解特点,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
13.在水中加入下列物质,能促进水的电离的是( )
| A. | H2SO4 | B. | KOH | C. | FeCl3 | D. | Ba (NO3)2 |
10.如图是有关电化学的图示,完全正确的是( )
| A. |  Cu-Zn原电池 | B. |  粗铜的精炼 | C. |  铁片镀锌 | D. |  减缓铁腐蚀 |
7.下列关于极性键的叙述不正确的是( )
| A. | 由不同种元素原子形成的共价键 | |
| B. | 由同种元素的两个原子形成的共价键 | |
| C. | 分子中必定含有极性键 | |
| D. | 共同电子对必然偏向吸引电子能力强的原子一方 |
8.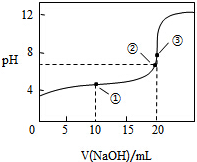 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )
 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )| A. | 点③溶液显碱性的原因是 CH3COO-+H2O═CH3COOH+OH- | |
| B. | 点②时溶液中c(Na+)大于c(CH3COO-) | |
| C. | 点①溶液中 c(CH3COOH)+c(H+)>c(CH3COO-)+c(OH-) | |
| D. | 在逐滴加入NaOH溶液至40mL的过程中,水的电离程度先增大后减小 |