题目内容
8.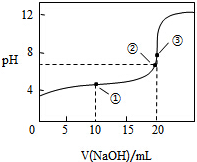 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )| A. | 点③溶液显碱性的原因是 CH3COO-+H2O═CH3COOH+OH- | |
| B. | 点②时溶液中c(Na+)大于c(CH3COO-) | |
| C. | 点①溶液中 c(CH3COOH)+c(H+)>c(CH3COO-)+c(OH-) | |
| D. | 在逐滴加入NaOH溶液至40mL的过程中,水的电离程度先增大后减小 |
分析 A.醋酸与NaOH恰好反应生成CH3COONa;
B.点②所示溶液中,NaOH的体积小于20mL,为醋酸和醋酸钠溶液,则c(Na+)<c(CH3COO-)+c(CH3COOH);
C.点①所示溶液中,为等浓度的醋酸和醋酸钠溶液,醋酸的电离程度大于醋酸根离子的水解,溶液显示酸性;
D.溶液中氢离子或氢氧根离子浓度越大,水的电离程度越小.
解答 解:A.点③溶液中醋酸与NaOH恰好反应生成CH3COONa,醋酸钠在溶液中水解显碱性,即CH3COO-+H2O═CH3COOH+OH-,故A正确;
B.点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-),故B错误;
C.点①溶液中,加入10mL氢氧化钠溶液,此时溶质为等浓度的醋酸和醋酸钠溶液,由于醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,则c(H+)>c(OH-),电荷守恒电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),c(CH3COOH)<c(Na+)<c(CH3COO-),所以溶液中c(CH3COOH)+c(H+)<c(CH3COO-)+c(OH-),故C错误;
D.溶液中氢离子或氢氧根离子浓度越大,水的电离程度越小,在逐滴加入NaOH溶液至40mL的过程中,溶液中氢离子浓度减小,水的电离程度增大,NaOH过量时,氢氧根离子抑制水的电离,所以水的电离程度减小,故D正确;
故选BC.
点评 本题考查酸碱混合溶液中离子浓度的关系,题目难度中等,明确混合后溶液中的溶质是解答的关键,注意电荷守恒、物料守恒及盐的水解在比较离子浓度大小中的应用方法.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
18.在甲酸溶液中加入一定量的NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是( )
| A. | c(HCOO-)<c(Na+) | B. | c(HCOO-)>c(Na+) | C. | c(OH-)>c(HCOO-) | D. | c(OH-)<c(HCOO-) |
19.酚酞的结构如图,则下列说法中正确的是( )


| A. | 分子式是C20H12O4 | B. | 能与NaOH稀溶液反应,溶液显红色 | ||
| C. | 能与溴水反应,溶液显红色 | D. | 与羧酸发生酯化反应 |
16.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 某温度时pH=6的纯水中含有10-6NA个H+ | |
| B. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 在25℃、1.01×105Pa时,121gCF2Cl2所含的氯原子数为2NA | |
| D. | 常温下,5.6g铁投入到足量的浓硝酸中,反应转移的电子数为0.3NA |
3. 某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取25.0mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
B.用标准NaOH溶液润洗滴定管2~3次
C.把盛有标注NaOH溶液的滴定管固定好,挤压玻璃球,使滴定管尖嘴充满溶液
D.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
E.调节液面值“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,进行滴定操作到终点,并记下滴定管液面的读数
回答下列问题:
(1)如图中属于酸式滴定管的甲(选填“甲”、“乙”).
(2)正确操作步骤的顺序是BDCEAF(填字母序号).
(3)上述B步操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(4)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色.
(5)下列哪些操作会使测定结果偏高AC(填序号).
A.碱式滴定管用蒸馏水洗净后未用标准液润洗
B.在振荡锥形瓶时不慎将瓶内溶液溅出
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(6)若平行实验三次,记录的数据如下表
试计算待测盐酸的物质的量浓度为0.0800mol•L-1.
 某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:A.移取25.0mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
B.用标准NaOH溶液润洗滴定管2~3次
C.把盛有标注NaOH溶液的滴定管固定好,挤压玻璃球,使滴定管尖嘴充满溶液
D.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
E.调节液面值“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,进行滴定操作到终点,并记下滴定管液面的读数
回答下列问题:
(1)如图中属于酸式滴定管的甲(选填“甲”、“乙”).
(2)正确操作步骤的顺序是BDCEAF(填字母序号).
(3)上述B步操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(4)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色.
(5)下列哪些操作会使测定结果偏高AC(填序号).
A.碱式滴定管用蒸馏水洗净后未用标准液润洗
B.在振荡锥形瓶时不慎将瓶内溶液溅出
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(6)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.00 | 22.99 |
| 3 | 25.00 | 0.20 | 20.19 |
13.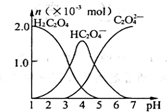 常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
( )
 常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
| A. | HC2O4-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10 mL,时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15 mL,时,溶液中存在:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20 mL,时,溶液中存在:c(OH-)=c(HC2O4-)+2c(H2C2O4)+c(H+) |
20.室温时,将浓度和体积分别为c1,V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A. | 当pH=7时,若V1=V2,则一定是c2>c1 | |
| B. | 在任何情况下都满足c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 若pH>7,则一定是c1V1>c2V2 | |
| D. | 若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
17.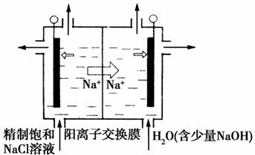 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
(1)①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:Cl--5e-+2H2O=ClO2↑+4H+.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为0.01mol.
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子.电池工作时正极反应为O2+4e-=2O2-.
(3)若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为0.1mol.
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.(1)①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:Cl--5e-+2H2O=ClO2↑+4H+.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为0.01mol.
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子.电池工作时正极反应为O2+4e-=2O2-.
(3)若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
18.NA为阿伏伽徳罗常数的值,下列说法正确的是( )
| A. | 1L 1mol/L的稀硝酸中,氧原子数为3NA | |
| B. | 常温常压下的67.2L氯气与54g铝充分反应,转移电子数为6NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电数为0.2NA | |
| D. | 标准状况下,80gSO3,中含3NA心个氧原子,体积约为22.4L |