题目内容
18.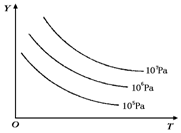 有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )
有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )| A. | G的转化率 | B. | 平衡混合气中R的体积分数 | ||
| C. | 平衡混合气中G的体积分数 | D. | 平衡混合气中L的体积分数 |
分析 L(s)+G(g)?2R(g)(正反应吸热),且L为固体,则升高温度,平衡正向移动,增大压强,平衡逆向移动,结合图象中曲线变化的特点解答该题.
解答 解:A.反应是吸热反应,升温正向进行,G的体积分数减小,转化率增大,图象不符合,故A错误;
B.反应是吸热反应,升温正向进行,R的体积分数增大,图象不符合,故B错误;
C.反应是吸热反应,升温正向进行,G的体积分数减小,压强增大,平衡左移,G的体积分数增大,图象符合,故C正确;
D.L为固体,体积分数基本不变,故D错误.
故选C.
点评 本题考查化学平衡移动影响因素,为高频考点,侧重考查学生识图能力及知识综合应用能力,明确温度、压强对化学平衡移动影响原理是解本题关键,难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
18.下列说法错误的是( )
| A. | 置换反应一定是氧化还原反应 | |
| B. | 有单质参加的反应一定是氧化还原反应 | |
| C. | 分解反应可能是氧化还原反应 | |
| D. | 凡是氧化还原反应都不可能是复分解反应 |
6.下列实验操作正确的是( )
| 编号 | 实验 | 操作 |
| A | 实验室用自来水制备蒸馏水 | 将自来水倒入烧杯中,小心给烧杯加热 |
| B | 配制一定浓度的氯化钾溶液100mL | 将称好的氯化钾固体放入100mL容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 检验溶液中是否含SO42- | 先加入稀盐酸,无明显现象,再加入BaCl2溶液 |
| D | 取出分液漏斗中的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| A. | A | B. | B | C. | C | D. | D |
13.为了使Na2CO3溶液中$\frac{C(N{a}^{+})}{C{{O}_{3}}^{2-}}$的比值变小,可加入的物质是( )
| A. | 适量盐酸 | B. | 适量NaOH | C. | 适量NaHCO3 | D. | 适量KOH |
3.下列化学用语正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙烷的结构式:C2H6 | ||
| C. | 苯的分子式: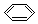 | D. |  --甲基的电子式. --甲基的电子式. |
10.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2LH2O 含有的分子数为0.5NA | |
| B. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| C. | 含有NA个氩原子的氩气在标准状况下的体积约为11.2L | |
| D. | 25℃,1.01×105 Pa,64gSO2中含有的原子数为3NA |
7.下列叙述正确的是( )
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性 | |
| C. | Li、Na、K的原子半径和密度随原子序数的增加而增大 | |
| D. | C、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |