题目内容
3.同温同压下,体积比为3:2的H2和CO,它们的物质的量之比是3:2,原子个数之比是3:2,质量之比是3:28,密度之比是1:14.分析 根据阿伏加德罗定律可知,同温同压下同体积比等于物质的量之比,根据分子的组成和分子的相对分子质量计算粒子个数以及质量、密度等关系.
解答 解:由V=nVm可知,同温同压下,体积比为3:2的H2和CO,它们的物质的量之比是3:2;则原子个数之比为3:2,
质量之比为3×2:2×28=3:28;
密度之比等于摩尔质量之比,为2:28=1:14,
故答案为:3:2;3:2;3:28; 1:14.
点评 本题考查阿伏加德罗定律及其推论,为高频考点,涉及物质的量的有关计算,题目难度不大,注意相关计算公式的运用.

练习册系列答案
相关题目
13.为了使Na2CO3溶液中$\frac{C(N{a}^{+})}{C{{O}_{3}}^{2-}}$的比值变小,可加入的物质是( )
| A. | 适量盐酸 | B. | 适量NaOH | C. | 适量NaHCO3 | D. | 适量KOH |
14.X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
请回答下列问题:
(1)W元素在周期表中的位置第三周期第VIIA族.
(2)X、Y、Z、W分别形成的简单离子的半径由小到大的顺序为O2-<N3-<Cl-<S2-(用化学式填写,下同);Y、Z对应的气态氢化物的稳定性H2O>H2S.
(3)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为2SO2(g)+O2(g)?2SO3(g)△H=-190.0kJ•mol-1.
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O=SO2+3S+4HCl.
| X | Y | |
| Z | W |
(1)W元素在周期表中的位置第三周期第VIIA族.
(2)X、Y、Z、W分别形成的简单离子的半径由小到大的顺序为O2-<N3-<Cl-<S2-(用化学式填写,下同);Y、Z对应的气态氢化物的稳定性H2O>H2S.
(3)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为2SO2(g)+O2(g)?2SO3(g)△H=-190.0kJ•mol-1.
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O=SO2+3S+4HCl.
11.某烃的结构简式如下: 分子中处于四面体中心位置的碳原子数为a,一定在同一直线上的碳原子个数为b,一定在同一平面上的碳原子数为c.则a、b、c分别为( )
分子中处于四面体中心位置的碳原子数为a,一定在同一直线上的碳原子个数为b,一定在同一平面上的碳原子数为c.则a、b、c分别为( )
 分子中处于四面体中心位置的碳原子数为a,一定在同一直线上的碳原子个数为b,一定在同一平面上的碳原子数为c.则a、b、c分别为( )
分子中处于四面体中心位置的碳原子数为a,一定在同一直线上的碳原子个数为b,一定在同一平面上的碳原子数为c.则a、b、c分别为( )| A. | 4、4、7 | B. | 4、3、6 | C. | 3、5、4 | D. | 2、6、4 |
15.在容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g),有如图所示的关系曲线,根据下图下列判断正确的是( )
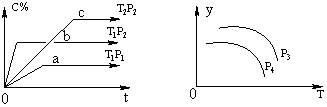

| A. | p3>p4,y轴表示A的物质的量分数 | |
| B. | 若增大A的浓度,平衡体系颜色加深,C一定是有颜色的气体 | |
| C. | p3<p4,y轴表示平衡常数K | |
| D. | p3>p4,y轴表示混合气体的平均摩尔质量 |
某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素.
该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
(1)该实验的目的是探究 、 对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明 ,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是 和 ,实验结论是 ;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响: .