题目内容
5.下列装置或操作能达到试验目的是( )| A. |  实验室制取并收集NH3 | B. |  石油的蒸馏 | ||
| C. |  检查装置气密性 | D. |  利用排空气发收集CO2 |
分析 A.收集氨气的集气瓶不能密封;
B.蒸馏时温度计测定馏分的温度;
C.关闭止水夹,可利用液差法检验气密性;
D.二氧化碳的密度比空气密度大.
解答 解:A.收集氨气的集气瓶不能密封,可塞一团棉花防止与空气对流,故A错误;
B.蒸馏时温度计测定馏分的温度,温度计的水银球应在支管口处,故B错误;
C.关闭止水夹,加水出现液差,一段时间不变,则气密性良好,故C正确;
D.二氧化碳的密度比空气密度大,应从长导管进气,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握气体的制备实验、混合物分离提纯实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析及实验装置的作用,题目难度不大.

练习册系列答案
相关题目
5.现有两份氨水.一份质量分数为 w%,物质的量浓度为c1 mol•L-1;另一份质量分数为2w%,物质的量浓度为c2 mol•L-1.下列说法不正确的是( )
| A. | c2<2c1 | |
| B. | 将两溶液等体积混合后,所得溶液的物质的量浓度为 0.5(c1+c2)mol•L-1 | |
| C. | 将两溶液等质量混合后,取 100mL 混合溶液,可恰好与 0.05(c1+c2)molCuSO4反应使 Cu2+完全沉淀 | |
| D. | 向 100g 质量分数为 2w%的氨水中加入 100g水,即得质量分数为 w%的氨水 |
13.为了使Na2CO3溶液中$\frac{C(N{a}^{+})}{C{{O}_{3}}^{2-}}$的比值变小,可加入的物质是( )
| A. | 适量盐酸 | B. | 适量NaOH | C. | 适量NaHCO3 | D. | 适量KOH |
10.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2LH2O 含有的分子数为0.5NA | |
| B. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| C. | 含有NA个氩原子的氩气在标准状况下的体积约为11.2L | |
| D. | 25℃,1.01×105 Pa,64gSO2中含有的原子数为3NA |
17.下列叙述正确的是( )
| A. | 氢氧化钠的摩尔质量是40 g | |
| B. | 1 mol NaOH的质量是40 g/mol | |
| C. | 1gH2和lgN2含分子数相等 | |
| D. | 等质量的N2、CH4、CO、H2O中,CH4含分子数最多 |
14.X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
请回答下列问题:
(1)W元素在周期表中的位置第三周期第VIIA族.
(2)X、Y、Z、W分别形成的简单离子的半径由小到大的顺序为O2-<N3-<Cl-<S2-(用化学式填写,下同);Y、Z对应的气态氢化物的稳定性H2O>H2S.
(3)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为2SO2(g)+O2(g)?2SO3(g)△H=-190.0kJ•mol-1.
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O=SO2+3S+4HCl.
| X | Y | |
| Z | W |
(1)W元素在周期表中的位置第三周期第VIIA族.
(2)X、Y、Z、W分别形成的简单离子的半径由小到大的顺序为O2-<N3-<Cl-<S2-(用化学式填写,下同);Y、Z对应的气态氢化物的稳定性H2O>H2S.
(3)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为2SO2(g)+O2(g)?2SO3(g)△H=-190.0kJ•mol-1.
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O=SO2+3S+4HCl.
15.在容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g),有如图所示的关系曲线,根据下图下列判断正确的是( )
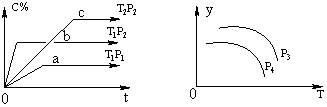

| A. | p3>p4,y轴表示A的物质的量分数 | |
| B. | 若增大A的浓度,平衡体系颜色加深,C一定是有颜色的气体 | |
| C. | p3<p4,y轴表示平衡常数K | |
| D. | p3>p4,y轴表示混合气体的平均摩尔质量 |