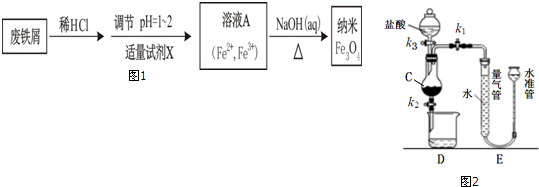
题目内容
11. 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的CH3COONa溶液的碱性大于NaClO溶液 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ | |
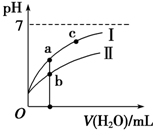
| C. | 图象 I代表CH3COOH溶液的稀释 | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
分析 A、酸的电离常数越大,则酸根离子的水解程度越小;
B、根据强酸制取弱酸判断,反应生成的应该为碳酸氢根离子;
C、酸性越强,加水稀释时,pH变化越大;
D、先根据电离程度大小判断醋酸、次氯酸对应曲线及起始浓度大小,a、b两点加入水的体积相同,则此时酸溶液浓度取决于酸的起始浓度.
解答 解:A、醋酸的电离常数大于次氯酸,所以醋酸钠的水解程度小于次氯酸钠,相同浓度的CH3COONa溶液的碱性小于NaClO溶液,故A错误;
B、碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故B错误;
C、稀释CH3COOH、HClO两种酸的稀溶液时,CH3COOH的酸性强,加水稀释时CH3COOH的pH变化大,所以图象 I代表CH3COOH溶液的稀释,故C正确;
D、pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故D错误.
故选C.
点评 本题考查电解质的强弱与电离常数的关系,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
17.在Na+浓度为0.5 mol•l-1的某澄清溶液中,还可能含有表中的若干种离子.
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
请回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是Ag+、Mg2+、Ba2+.
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
| 阳离子 | K+ Ag+ Mg2+ Ba2+ |
| 阴离子 | NO3- CO32- SiO32- SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验Ⅰ能确定一定不存在的离子是Ag+、Mg2+、Ba2+.
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c(mol•h-1) |
19. 高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
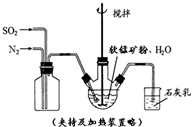
①缓慢向烧瓶中(见图)通入过量混合气进行“浸锰”操作,主要反应原理为:SO2+H2O=H2SO3;MnO2+H2SO3=MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰.请回答:
(1)石灰乳参与反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O.
(2)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如下图,为减少MnS2O6 的生成,“浸锰”过程适宜的温度是150℃(或150℃以上).

(3)查阅下表回答②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去.
(4)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4溶液.用平衡移动原理解释加入MnS的作用MnS(S)?Mn2+(aq)+S2-(aq)、S2-(aq)+Cu2+(aq)?CuS(S) 生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)④中加入NH4HCO3后发生反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(6)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解.请问用少量C2H5OH洗涤的原因是防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.
 高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):①缓慢向烧瓶中(见图)通入过量混合气进行“浸锰”操作,主要反应原理为:SO2+H2O=H2SO3;MnO2+H2SO3=MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰.请回答:
(1)石灰乳参与反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O.
(2)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如下图,为减少MnS2O6 的生成,“浸锰”过程适宜的温度是150℃(或150℃以上).

(3)查阅下表回答②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去.
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(5)④中加入NH4HCO3后发生反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(6)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解.请问用少量C2H5OH洗涤的原因是防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.
3.下列物质中属于弱电解质的是( )
| A. | 氨水 | B. | 盐酸 | C. | 碳酸氢钠 | D. | 冰醋酸 |
20.在0.1mol•L-1氨水中存在如下电离平衡:NH3•H2O?NH4++OH-,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,溶液中c(OH-) 增大 | |
| B. | 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小 | |
| C. | 通入少量HCl气体,溶液中c(NH4+)增大 | |
| D. | 降低温度,促进NH3•H2O电离 |
1.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
| A. | 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+c( C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
 300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:
300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题: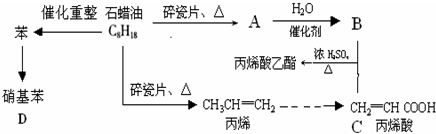
 A→B的反应类型:加成反应
A→B的反应类型:加成反应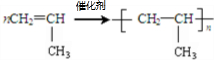 ;
;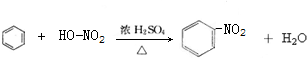 ,
,