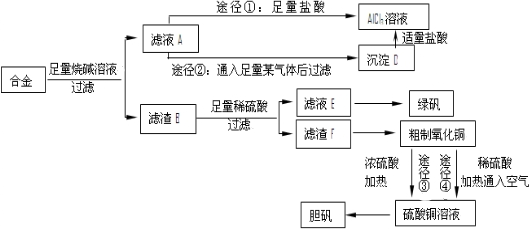
��Ŀ����
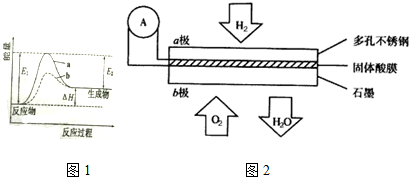
16�����÷���м������������--Fe2O3���Ʊ�����Fe3O4��������ͼ1��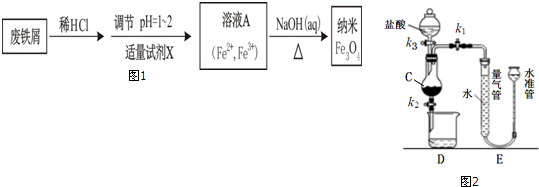
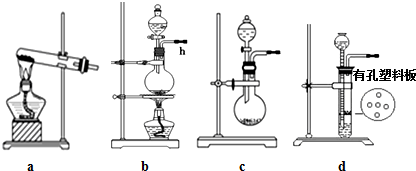
����ͼ2װ���Ʊ���ҺA����ʵ�鲽��Ϊ��
��k1���ر�k2������k3�������μ����
����ʱ���ر�k3����װ��E���ж���������
�ر�k1����k2��k3��ʹC�����е���Һ��ȫ�����ձ���
�������ձ��м��������Լ�X���õ���ҺA��
��ش�
��1��ʢ���������������Ϊ��Һ©����
��2��Ҫ���Բⶨ����м������������������ͨ��װ��E���C��������������������
���������������ȷ����c����ѡ����ĸ��
a����CCl4����E�е�ˮ���������������ȷ
b��������ѹ��ˮ�ܵ�ˮ�����������ᵼ�²ⶨʧ��
c�������װ�ûָ�����������������ˮ������Һ����ƽ�ſɽ��ж���
�ڲ������С�����������������C�й�����ȫ��ʧ������C�в��������ݣ�
��3���Ʊ���ҺA���Լ�X����ѡ��abd����ѡ����ĸ����
a��H2O2 b��Cl2 c��SO2 d��HNO3
��4��д������ҺA�Ʊ�����Fe3O4�����ӷ���ʽFe2++2Fe3++8OH-$\frac{\underline{\;\;��\;\;}}{\;}$Fe3O4+4H2O���Ʊ������������ͨ��N2��ԭ������ N2�����£���ֹFe2+��������
��5��Fe3O4�Ĵ���ͨ�����õ������ⶨ����ȡm g Fe3O4��Ʒ������ϡ���ᣬ���Ƴ�100mL��Һ��ȡ��10.00mL�������Թ�����KI��Һ����ַ�Ӧ���뼸�ε�����Һ������c mol•L-1 Na2S2O3��Һ�ζ�������V mL����֪��I2+2S2O32-�T2I-+S4O62-����
�ٵζ��յ����������Һ��ɫ��ȥ���Ұ���Ӳ���ɫ��
����Ʒ��Fe3O4����������$\frac{116cV}{m}$%��
���� ��м��ϡ�����ܽ�õ��Ȼ�������Һ��������ҺpH�������Լ�X������������ΪFe2+������Fe3+�������ǹ����������ˮ�ȣ��ټ���NaOH��Һ�����ȵõ�����Fe3O4��
��1��ʢ�����������Ϊ��Һ©����
��2����a������������ˮ�����Ȼ�̼����CCl4�ӷ���
b��������ѹ��ˮ��Һ��ȸߣ����ɲⶨ���������
c�������DZ�֤װ����ѹǿ��������ѹ��ȣ����������¶������������ȴ��������С��
�ڲ������Dz������������������Ҫװ��C��Fe��ȫ��Ӧ��
��3���Ʊ���ҺA���Լ�X�ǽ���������ΪFe2+������Fe3+����Ҫѡ�����ǿ�����Ե����ʣ�
��4��Fe2+��Fe3+�ڼ��ԡ����������·�Ӧ�õ�Fe3O4������ˮ���ɣ��Ʊ��з�ֹ�������ӱ�����������
��5���������ӽ�����������Ϊ�ⵥ�ʣ����������Һ����ɫ���ζ��յ�ʱ��ɫ��ȥ��
�ڸ��ݹ�ϵʽ��Fe3O4��2Fe3+��I2��2S2O32-���㣮
��� �⣺��м��ϡ�����ܽ�õ��Ȼ�������Һ��������ҺpH�������Լ�X������������ΪFe2+������Fe3+�������ǹ����������ˮ�ȣ��ټ���NaOH��Һ�����ȵõ�����Fe3O4��
��1��ʢ�����������Ϊ��Һ©����
�ʴ�Ϊ����Һ©����
��2����a������������ˮ�����Ȼ�̼����Ӱ����������������CCl4�ӷ�����Ⱦ��������a����
b��������ѹ��ˮ�ܵ�ˮ������������������ѹ��ˮ��Һ��ȸߣ����ɲⶨ������������ᵼ��ʵ��ʧ�ܣ���b����
c�������DZ�֤װ����ѹǿ��������ѹ��ȣ����������¶������������ȴ��������С��Ӧ�ָ����£���c��ȷ��
��ѡ��c��
�ڲ������Dz������������������Ҫװ��C��Fe��ȫ��Ӧ������C�й�����ȫ��ʧ������C�в��������ݣ�˵����Ӧ��ȫ��
�ʴ�Ϊ������C�й�����ȫ��ʧ������C�в��������ݣ�
��3���Ʊ���ҺA���Լ�X�ǽ���������ΪFe2+������Fe3+����Ҫѡ�����ǿ�����Ե����ʣ���������ˮ��������������ᣬ�����ӿ���������������
��ѡ��abd��
��4��Fe2+��Fe3+�ڼ��ԡ����������·�Ӧ�õ�Fe3O4������ˮ���ɣ���Ӧ���ӷ���ʽΪ��Fe2++2Fe3++8OH-$\frac{\underline{\;\;��\;\;}}{\;}$Fe3O4+4H2O���� N2�����£���ֹFe2+������
�ʴ�Ϊ��Fe2++2Fe3++8OH-$\frac{\underline{\;\;��\;\;}}{\;}$Fe3O4+4H2O���� N2�����£���ֹFe2+��������
��5���������ӽ�����������Ϊ�ⵥ�ʣ����������Һ����ɫ����Na2S2O3��Һ�ζ��ζ��ⵥ�ʣ��ζ��յ�������ǣ���Һ��ɫ��ȥ���Ұ���Ӳ���ɫ��
�ʴ�Ϊ����Һ��ɫ��ȥ���Ұ���Ӳ���ɫ��
������Ʒ��Fe3O4����������Ϊa����
Fe3O4��2Fe3+��I2��2S2O32-
232g 2mol
ma g V��10-3L��c mol/L��$\frac{100mL}{10mL}$
����232g��ma g=2mol��V��10-3L��c mol/L��$\frac{100mL}{10mL}$
���a=$\frac{116cV}{m}$%
�ʴ�Ϊ��$\frac{116cV}{m}$%��
���� ���⿼�������Ʊ�ʵ���붨���ⶨʵ�飬�ؼ��Ƕ�ԭ�������⣬���������������������ζ��й�ϵʽ���㣬��������Ԫ�ػ��������ʣ���Ŀ������ѧ������������֪ʶǨ������������

 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�| A�� | sp2�ӻ�����γɦҼ���δ�ӻ���2p����γɦм� | |
| B�� | sp2�ӻ�����γɦм���δ�ӻ���2p����γɦҼ� | |
| C�� | C��H֮���γɵ���s-p �Ҽ���C��C֮��Ħм���δ�μ��ӻ���2p����γɵ� | |
| D�� | C��C֮���γɵ���sp2-sp2�Ҽ���C��H֮����δ�μ��ӻ���2p����γɵĦм� |
 ��֪���±�Ϊ25��ʱijЩ����ĵ���ƽ�ⳣ����
��֪���±�Ϊ25��ʱijЩ����ĵ���ƽ�ⳣ����| CH3COOH | HClO | H2CO3 |
| Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.4��10-7Ka2=4.7��10-11 |
| A�� | 25��ʱ����ͬŨ�ȵ�CH3COONa��Һ�ļ��Դ���NaClO��Һ | |
| B�� | ��NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ2ClO-+CO2+H2O�T2HClO+CO${\;}_{3}^{2-}$ | |
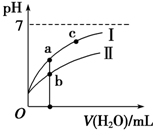
| C�� | ͼ�� I����CH3COOH��Һ��ϡ�� | |
| D�� | ͼ����a�������Ũ�ȴ���b�������Ũ�� |
��1����֪��2CO��g��+O2��g���T2CO2��g������H=-566kJ•moL-1
2H2��g��+O2��g���T2H2O��g������H=-483.6KJ•moL-1
H2O ��g���TH2O��l������H=-44.0KJ•moL-1
д��CO��H2O��g����������CO2��H2���Ȼ�ѧ����ʽCO��g��+H2O��g��=H2��g��+CO2��g����H=-41.2KJ•moL-1
��2����850��ʱ����Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����K=1��
�٣��������¶ȵ�950��ʱ���ﵽƽ��ʱK��1�����������������=������
�ڣ�850��ʱ������һ�ݻ��ɱ���ܱ�������ͬʱ����1.0mol CO��3.0mol H2O��1.0mol CO2��x mol H2����Ҫʹ������Ӧ��ʼʱ������Ӧ������У���xӦ�����������x��3��
�ۣ��ڢڵ������£������м��Ϸ�ʽ���ϣ��ﵽƽ��ʱH2������������£�
| ���Ϸ�ʽ��mol�� | H2��������� | ||||
| ���� | CO��g�� | H2O��g�� | CO2��g�� | H2��g�� | |
| ����һ | 1 | 3 | 0 | 0 | a% |
| ���϶� | 0 | 1.2 | 0.6 | 0.6 | b% |
��3��H2��һ���������ɫ��Դ������ȼ�ϵ�أ�
����������ȼ�ϵ����KOHΪ�������Һ���������ĵ缫��Ӧʽ��O2+4e-+2H2O�T4OH-
����25��ʱ��������ȼ�ϵ��Ϊ��Դ����ʯī�缫���1000mLһ��Ũ�ȵ�CuSO4��Һ��5min������ȫ����һ��ʯī�缫��ֻ��1.28g Cu���ɣ��Իش��������⣺
�����ܷ�ӦʽΪ2CuSO4+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2Cu+O2��+2H2SO4��
��������ת�Ƶĵ�����Ϊ0.08mol��ͬʱ���ɱ�״������������Ϊ0.896L��
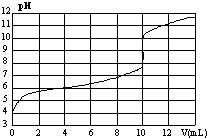 �����£���ijŨ��NaOH��Һ�ζ�һԪ��HA�ĵζ�������ͼ��ʾ��������Ϊ����NaOH�������������Ϊ���û��Һ��pH���������ж���ȷ����
�����£���ijŨ��NaOH��Һ�ζ�һԪ��HA�ĵζ�������ͼ��ʾ��������Ϊ����NaOH�������������Ϊ���û��Һ��pH���������ж���ȷ������������
| A�� | HA��Ũ��Ϊ1��10-4mol•L-1 | B�� | ʵ��ʱ��ѡ������ָʾ�� | ||
| C�� | pH=7ʱ����Һ��c��Na+����c��A-�� | D�� | V=10mL�����ǡ���к� |