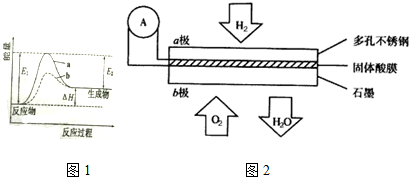
题目内容
2. 300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:
300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:(1)能证明反应已经达到平衡状态的是④⑤
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2v(SO3)=v(O2)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
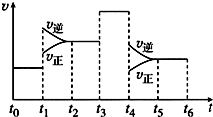
(2)如图表示该反应的速率(v)随时间(t)的变化的关系:据图分析:你认为t3时改变的外界条件可能是加催化剂;t6时保持体积不变向体系中充入少量He气,平衡不移动.(填“向左”“向右”或“不”).SO2%含量最高的区间是t5~t6(t0~t1,t2~t3,t3~t4,t5~t6),
(3)300℃时,该反应的平衡常数为11.25,若升高温度该反应的平衡常数减小,则△H小于0(填“大于”小于“或“不确定”)
(4)如果在相同条件下,上述反应从逆反应方向进行,开始时加入SO20.6mol加入SO31.4mol,若使平衡时各物质的量浓度与原来平衡相同,则还应加入O20.3mol.
分析 (1)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;
(2)如图表示该反应的速率(v)随时间(t)的变化的关系:据图分析:t1时正逆反应速率增大,而反应是放热反应,所以t1时是升高温度,t3时正逆反应速率同等程度增大,而反应前后两边的计量数不等,所以t3时使用催化剂t4改变的条件是减小压强;t6时保持体积不变向体系中充入少量He气,各组分的浓度不变,平衡不移动,SO3%含量最高的区间是t0~t1;
(3)根据三行式求平衡时各物质的浓度,然后代入平衡常数表达式计算;若升高温度该反应的平衡常数减小,说明正反应是放热反应;
(4)该反应前后气体的物质的量不变,恒温恒容下,按化学计量数转化到左边,得2mol SO21mol O2才与原来平衡相同,由此分析解答.
解答 解:(1)①平衡时c(SO2):c(O2):c(SO3)可能是2:1:2,也可能不是,与起始投料量和转化率有关,故错误;
②单位时间内生成nmol SO3的同时消耗nmol SO2,都体现正反应方向,未体现正与逆的关系,故错误;
③反应速率2v(SO3)=v(O2),未体现正与逆的关系,故错误;
④温度和体积一定时,容器内压强不再变化,说明气体的物质的量不变,反应达平衡状态,故正确;
⑤温度和压强一定时,混合气体的密度不再变化,说明气体的平均相对分子量不变,反应达平衡状态,故正确;
故选:④⑤;
(2)如图1表示该反应的速率(v)随时间(t)的变化的关系:据图分析:t1时正逆反应速率增大,但增大程度不同,逆反应速率增大的大,反应是放热反应,所以t1时改变的条件是升温,t3时正逆反应速率同等程度增大,而反应前后两边的计量数不等,所以t3时使用催化剂t4改变的条件是减小压强,t6时保持体积不变向体系中充入少量He气,各组分的浓度不变,平衡不移动,上述分析可知,t3时改变的外界条件可能是加催化剂;t6时保持体积不变向体系中充入少量He气,平衡不移动;SO2%含量最高的区间是t5~t6,
故答案为:加催化剂;不;t5~t6;
(3)2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L):1 0.5 0
变化量(mol/L):0.6 0.3 0.6
平衡量(mol/L):0.4 0.2 0.6
所以K=$\frac{0.{6}^{2}}{0.{4}^{2}×0.2}$=11.25,若升高温度该反应的平衡常数减小,说明正反应是放热反应,所以△H<0,
故答案为:11.25; 小于;
(4)将SO20.6mol和SO31.4mol全部转化为反应物,则将(1.4mol+0.6mol)=2mol SO2和0.7mol O2,所以还需投氧气的量为1-0.7=0.3 mol,故答案为:0.3.
点评 本题考查化学平衡的有关计算、影响化学平衡的因素、等效平衡等,难度中等,注意等效平衡规律的掌握.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | ag某气体的分子数为b,则cg该气体在标况下的体积为$\frac{22.4bc}{a{N}_{A}}$L | |
| B. | 2L0.5mol.L-1磷酸溶液中含有H+的数目为3NA | |
| C. | 25℃,PH=13的Ba(OH)2溶液中含有OH-为0.1NA | |
| D. | 标准状况下,28g乙烯和丙烯的混合气体中,含有碳碳双键的数目为NA |
| A. | 五种元素的原子半径从大到小的顺序是:Z>W>M>Y>X | |
| B. | 氢化物的还原性:Y>M>W | |
| C. | Y和M的氧化物都是酸性氧化物 | |
| D. | X2Z的电子式为: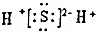 |
| A. | Fe | B. | Cu | C. | 氯水 | D. | KSCN溶液 |
 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
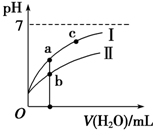
| A. | 25℃时,相同浓度的CH3COONa溶液的碱性大于NaClO溶液 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ | |
| C. | 图象 I代表CH3COOH溶液的稀释 | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
| A. | H3的摩尔质量是3g | |
| B. | H3是氢元素的一种新的同位素 | |
| C. | H3分子中含有3个中子 | |
| D. | H2和H3是氢元素形成的两种不同单质 |
 将400mL稀硫酸和稀硝酸的混合溶液平分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g铜,且反应后溶液中还有硫酸剩余;向另一份中逐渐加入铁粉,产生气体的体积和所加铁粉质量的变化关系如图所示.请回答下列问题(假设硝酸只被还原为NO气体):
将400mL稀硫酸和稀硝酸的混合溶液平分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g铜,且反应后溶液中还有硫酸剩余;向另一份中逐渐加入铁粉,产生气体的体积和所加铁粉质量的变化关系如图所示.请回答下列问题(假设硝酸只被还原为NO气体):