题目内容
1.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )| A. | 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+c( C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
分析 A.②④中碳酸根离子浓度较大,①中碳酸根离子浓度最小,然后结合盐的水解情况分析碳酸根离子浓度大小;
B.根据混合液中的电荷守恒判断;
C.反应后溶质为等浓度的碳酸钠和碳酸氢钠,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-);
D.pH小于7,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH).
解答 解:A.②④相比较,由于④发生互促水解,水解程度较大,则c(CO32-)②>④;①为二元弱酸,c(CO32-)最小,则c(CO32-)的大小关系为::②>④>③>①,故A正确;
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合,根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+2c( C2O42-),故B错误;
C.0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液,反应后溶质为等浓度的碳酸钠和碳酸氢钠,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),离子浓度大小为:c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知:c(CH3COOH)+c(OH-)<c(Na+)+c(H+),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.

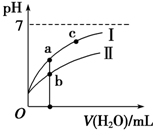 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的CH3COONa溶液的碱性大于NaClO溶液 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ | |
| C. | 图象 I代表CH3COOH溶液的稀释 | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
| A. | H3的摩尔质量是3g | |
| B. | H3是氢元素的一种新的同位素 | |
| C. | H3分子中含有3个中子 | |
| D. | H2和H3是氢元素形成的两种不同单质 |
| A. | Mg和Zn | B. | Mg和Al | C. | Fe和Zn | D. | Cu和Fe |
| A. | 原混合溶液中钾离子浓度为2 mol/L | |
| B. | 上述电解过程中共转移6摩尔电子 | |
| C. | 电解得到的铜的物质的量为0.5摩尔 | |
| D. | 电解后溶液中的pH=2 |
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
| A. | 60℃时,NaCl溶液的pH<7,则溶液呈酸性 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 相同温度下,1 mol•L-1氨水与0.5 mol•L-1氨水中c(OH-)之比是2:1 |
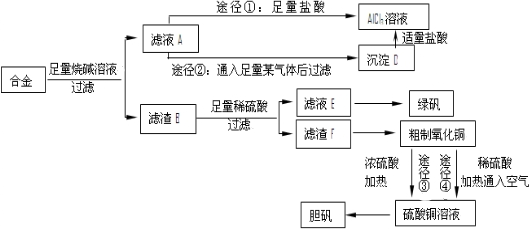

 (或
(或
 ).
).