题目内容
20.在0.1mol•L-1氨水中存在如下电离平衡:NH3•H2O?NH4++OH-,对于该平衡,下列叙述正确的是( )| A. | 加入水时,溶液中c(OH-) 增大 | |
| B. | 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小 | |
| C. | 通入少量HCl气体,溶液中c(NH4+)增大 | |
| D. | 降低温度,促进NH3•H2O电离 |
分析 氨水溶液中存在的电离平衡NH3•H2O?NH4++OH-,向氨水中加入水促进一水合氨电离,加入含有铵根离子或氢氧根离子的物质抑制其电离,加入和铵根离子或氢氧根离子反应的物质促进其电离,电离为吸热过程,据此来分析.
解答 解:氨水溶液中存在的电离平衡:NH3•H2O?NH4++OH-,
A.向氨水加入水,促进NH3•H2O电离,平衡向正反应方向移动,n(OH-)增大,但c(OH-)减小,溶液pH变小,故A错误;
B.向氨水中加入少量NH4Cl固体,溶液中c(NH4+)增大,平衡向逆反应方向移动,电离常数不变,故B错误;
C.向氨水中通入少量HCl气体,氢离子和氢氧根离子反应,导致溶液中n(OH-)减小,平衡向正反应方向移动,溶液中c(NH4+)增大,故C正确;
D.电离为吸热过程,电离平衡向逆反应方向移动,故D错误;
故选C.
点评 本题考查了弱电解质的电离,明确哪些条件促进其电离、哪些条件抑制其电离是解本题关键,注意加水稀释促进一水合氨电离,但溶液中氢氧根离子浓度减小,为易错点,题目难度不大.

练习册系列答案
相关题目
11. 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.
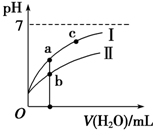
图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的CH3COONa溶液的碱性大于NaClO溶液 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ | |
| C. | 图象 I代表CH3COOH溶液的稀释 | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
8.为了减少CO对大气的污染,某学习小组拟研究CO和H2O反应转化为绿色能源H2
(1)已知:2CO(g)+O2(g)═2CO2(g);△H=-566kJ•moL-1
2H2(g)+O2(g)═2H2O(g);△H=-483.6KJ•moL-1
H2O (g)═H2O(l);△H=-44.0KJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1
(2)在850℃时,反应:CO(g)+H2O(g)?CO2(g)+H2(g)的K=1.
①:若升高温度到950℃时,达到平衡时K<1(填“>”、“<”或“=”).
②:850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是x<3.
③:在②的条件下,按下列加料方式加料,达到平衡时H2的体积分数如下:
则:a=b(填“>”、“<”或“=”).
(3)H2是一种理想的绿色能源,可作燃料电池.
①若该氢氧燃料电池以KOH为电解质溶液,其正极的电极反应式是O2+4e-+2H2O═4OH-
②在25℃时,以氢氧燃料电池为电源,用石墨电极电解1000mL一定浓度的CuSO4溶液.5min后电解完全,在一个石墨电极上只有1.28g Cu生成.试回答下列问题:
电解的总反应式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
电解过程中转移的电子数为0.08mol,同时生成标准状况下气体的体积为0.896L.
(1)已知:2CO(g)+O2(g)═2CO2(g);△H=-566kJ•moL-1
2H2(g)+O2(g)═2H2O(g);△H=-483.6KJ•moL-1
H2O (g)═H2O(l);△H=-44.0KJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1
(2)在850℃时,反应:CO(g)+H2O(g)?CO2(g)+H2(g)的K=1.
①:若升高温度到950℃时,达到平衡时K<1(填“>”、“<”或“=”).
②:850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是x<3.
③:在②的条件下,按下列加料方式加料,达到平衡时H2的体积分数如下:
| 加料方式(mol) | H2的体积分数 | ||||
| 物质 | CO(g) | H2O(g) | CO2(g) | H2(g) | |
| 加料一 | 1 | 3 | 0 | 0 | a% |
| 加料二 | 0 | 1.2 | 0.6 | 0.6 | b% |
(3)H2是一种理想的绿色能源,可作燃料电池.
①若该氢氧燃料电池以KOH为电解质溶液,其正极的电极反应式是O2+4e-+2H2O═4OH-
②在25℃时,以氢氧燃料电池为电源,用石墨电极电解1000mL一定浓度的CuSO4溶液.5min后电解完全,在一个石墨电极上只有1.28g Cu生成.试回答下列问题:
电解的总反应式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
电解过程中转移的电子数为0.08mol,同时生成标准状况下气体的体积为0.896L.
15.K、Ka、KW分别表示化学平衡常数、电离平衡常数和水的离子积,下列判断正确的是( )
| A. | 温度升高,三者都增大 | |
| B. | 室温下Ka(HCN)<Ka(CH3COOH),说明CH3COOH的电离度一定比HCN大 | |
| C. | 2SO2(g)+O2(g)?2SO3(g)平衡后,仅增大压强,平衡向右移动,但K值不变 | |
| D. | 化学平衡常数的大小与温度、浓度、催化剂等有关 |
5.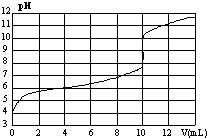 室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是
( )
 室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是( )
| A. | HA的浓度为1×10-4mol•L-1 | B. | 实验时可选甲基橙作指示剂 | ||
| C. | pH=7时,溶液中c(Na+)>c(A-) | D. | V=10mL,酸碱恰好中和 |
12.据报道,科学家已成功合成了H3,下列说法正确的是( )
| A. | H3的摩尔质量是3g | |
| B. | H3是氢元素的一种新的同位素 | |
| C. | H3分子中含有3个中子 | |
| D. | H2和H3是氢元素形成的两种不同单质 |
9.有两种金属的合金13g,与足量稀硫酸反应后,在标准状况下产生气体11.2L,则组成该合金的金属可能是( )
| A. | Mg和Zn | B. | Mg和Al | C. | Fe和Zn | D. | Cu和Fe |
10.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |