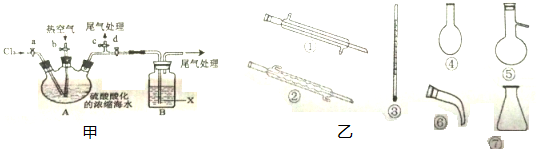
题目内容
目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点.
(1)在处理水的过程中,Na2FeO4起到杀菌、消毒、净水的作用,请说明应用了Na2FeO4的哪些性质:
(2)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2?7H2O,过程如下:
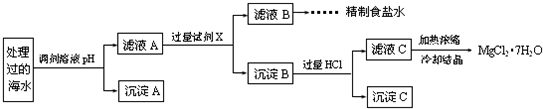
Ksp[Fe(OH)3]=1.0×10-38;Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积的变化忽略不计.
①表格中的a 0.16(填“<”、“>”或“=”).
②沉淀A的组成为 (填化学式);在调节溶液pH时,理论上应调节的pH的范围是 .
③加入的过量试剂X为 (填化学式).
④加入过量HCl的作用为 .
(1)在处理水的过程中,Na2FeO4起到杀菌、消毒、净水的作用,请说明应用了Na2FeO4的哪些性质:
(2)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |

Ksp[Fe(OH)3]=1.0×10-38;Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积的变化忽略不计.
①表格中的a
②沉淀A的组成为
③加入的过量试剂X为
④加入过量HCl的作用为
考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:(1)高铁酸钠具有强氧化性,可用于杀菌消毒,还原生成Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质;
(2)①由表中Mg2+、Fe3+的浓度及Ksp[Fe(OH)3、Ksp[Mg(OH)2]可知,该溶液呈酸性,再利用电荷守恒可知,2c(SO42-)+c(Cl-)+c(OH-)=2c(Mg2+)+3c(Fe3+)+c(Na+)+c(H+),据此判断.
②由工艺流程图可知,处理的海水调节PH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+.
③由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,据此判断X.
④由工艺流程图可知,盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,抑制Mg2+水解.
(2)①由表中Mg2+、Fe3+的浓度及Ksp[Fe(OH)3、Ksp[Mg(OH)2]可知,该溶液呈酸性,再利用电荷守恒可知,2c(SO42-)+c(Cl-)+c(OH-)=2c(Mg2+)+3c(Fe3+)+c(Na+)+c(H+),据此判断.
②由工艺流程图可知,处理的海水调节PH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+.
③由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,据此判断X.
④由工艺流程图可知,盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,抑制Mg2+水解.
解答:
解:(1)高铁酸钠具有强氧化性,可用于杀菌消毒,还原生成Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,可用来除去水中的悬浮物,达到净水的目的,
故答案为:Na2FeO4有强氧化性可杀菌、消毒;还原生成Fe3+,其水解产物Fe(OH)3胶体可吸附水中悬浮物一起沉降,起净水的作用;
(2)①由Ksp[Fe(OH)3、Ksp[Mg(OH)2]可知,Mg2+完全沉淀时c(OH-)=10-5mol/L,Fe3+完全沉淀时c(OH-)=10-11mol/L,由表中Mg2+、Fe3+的浓度可知,该溶液呈酸性,c(H+)>c(OH-),利用电荷守恒可知,2c(SO42-)+c(Cl-)+c(OH-)=2c(Mg2+)+3c(Fe3+)+c(Na+)+c(H+),即2a+0.58+c(OH-)=2×0.05+3×0.1+0.5+c(H+),整理2a=0.32+c(H+)-c(OH-),由于c(H+)>c(OH-),所以a>0.16,
故答案为:>;
②由工艺流程图可知,处理的海水调节PH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+,故沉淀A的组成为Fe(OH)3,
Mg2+完全沉淀时c(OH-)=10-5mol/L,PH值为9,Fe3+完全沉淀时c(OH-)=10-11mol/L,pH值为3,在调节溶液pH时,应当使3≤pH<9,
故答案为:Fe(OH)3;3≤pH<9;
③由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,故试剂X为Ba(OH)2,故答案为:Ba(OH)2;
④由工艺流程图可知,盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,可以抑制Mg2+水解,
故答案为:使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.
故答案为:Na2FeO4有强氧化性可杀菌、消毒;还原生成Fe3+,其水解产物Fe(OH)3胶体可吸附水中悬浮物一起沉降,起净水的作用;
(2)①由Ksp[Fe(OH)3、Ksp[Mg(OH)2]可知,Mg2+完全沉淀时c(OH-)=10-5mol/L,Fe3+完全沉淀时c(OH-)=10-11mol/L,由表中Mg2+、Fe3+的浓度可知,该溶液呈酸性,c(H+)>c(OH-),利用电荷守恒可知,2c(SO42-)+c(Cl-)+c(OH-)=2c(Mg2+)+3c(Fe3+)+c(Na+)+c(H+),即2a+0.58+c(OH-)=2×0.05+3×0.1+0.5+c(H+),整理2a=0.32+c(H+)-c(OH-),由于c(H+)>c(OH-),所以a>0.16,
故答案为:>;
②由工艺流程图可知,处理的海水调节PH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+,故沉淀A的组成为Fe(OH)3,
Mg2+完全沉淀时c(OH-)=10-5mol/L,PH值为9,Fe3+完全沉淀时c(OH-)=10-11mol/L,pH值为3,在调节溶液pH时,应当使3≤pH<9,
故答案为:Fe(OH)3;3≤pH<9;
③由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,故试剂X为Ba(OH)2,故答案为:Ba(OH)2;
④由工艺流程图可知,盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,可以抑制Mg2+水解,
故答案为:使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.
点评:考查氧化还原反应、溶度积计算、沉淀转化、溶液的有关计算、对化学工艺流程的理解、物质的分离提纯等,难度中等,(2)①为易错点、难点,根据电荷守恒判断原理、判断溶液的酸碱性是关键.

练习册系列答案
相关题目
生活是化学的源泉,下列有关生活中的化学叙述不正确的是( )
| A、铁强化酱油可通过膳食补充人体所需的铁元素 |
| B、变质的植物油有难闻的特殊气味,是由于植物油发生了水解反应 |
| C、一定浓度的双氧水可用于伤口的消毒 |
| D、蔬菜中含有维生素C,生吃新鲜蔬菜要比熟吃时维生素C的损失大 |
等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出H2最多的是( )
| A、2mol/L H2SO4溶液 |
| B、3mol/L CuSO4溶液 |
| C、6mol/L KOH溶液 |
| D、3mol/L Ba(OH)2溶液 |
下列操作中不正确的是( )
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、过滤操作时,玻璃棒与三层滤纸的一边接触 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、萃取操作时,一般选择有机萃取剂,且萃取剂必须与水不互溶 |
将铁屑溶于过量盐酸后,再加入下列物质:①硫酸②硝酸锌③氯化铜④氯水,产生的Fe3+是( )
| A、①④ | B、②④ | C、只有④ | D、①③ |
 在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表: