题目内容
15.现有八种物质:①HCl ②Na2SO4晶体 ③浓硝酸 ④铜 ⑤烧碱 ⑥蔗糖 ⑦C12⑧SO2(1)上述物质中可导电的是③④(填序号)
(2)上述物质中属于非电解质的是⑥⑧(填序号)
(3)写出②溶于水的电离方程式Na2SO4=2Na++SO42-
(4)写出⑧与足量的⑤在溶液中反应的离子方程式2OH-+SO2=H2O+SO32-
(5)在③与④的反应中,还原产物为二氧化氮(NO2).
分析 (1)物质导电的条件为存在自由电子或者自由移动的离子;
(2)电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
单质和混合物既不是电解质,也不是非电解质;
(3)硫酸钠为强电解质,水溶液中完全电离出钠离子和硫酸根离子;
(4)二氧化硫与足量氢氧化钠反应生成亚硫酸钠和水;
(5)铜与浓硝酸反应生成硝酸铜、二氧化碳和水,依据反应中元素化合价变化判断还原产物.
解答 解:(1)①HCl不含自由电子和自由移动的离子,不导电;
②Na2SO4晶体不含自由电子和自由移动的离子,不导电;
③浓硝酸含有自由移动的离子,能够导电;
④铜含有自由电子,能导电;
⑤烧碱不含自由电子和自由移动的离子,不导电;
⑥蔗糖不含自由电子和自由移动的离子,不导电;
⑦C12不含自由电子和自由移动的离子,不导电;
⑧SO2不含自由电子和自由移动的离子,不导电;
所以能导电的为:③④;
故答案为:③④;
(2)①HCl水溶液中能导电,是化合物,属于电解质;
②Na2SO4晶体在水溶液中或熔融状态下能导电的化合物,是电解质;
③浓硝酸是混合物,既不是电解质也不是非电解质;
④铜是单质,既不是电解质也不是非电解质;
⑤烧碱在水溶液中或熔融状态下能导电的化合物,是电解质;
⑥蔗糖 在水溶液中和熔融状态下不能导电的化合物,是非电解质;
⑦C12 是单质,既不是电解质也不是非电解质;
⑧SO2在水溶液中和熔融状态下不能导电的化合物,是非电解质;
所以是非电解质的为:⑥⑧;
故答案为:⑥⑧;
(3)硫酸钠为强电解质,水溶液中完全电离出钠离子和硫酸根离子,电离方程式:Na2SO4=2Na++SO42-
;
故答案为:Na2SO4=2Na++SO42-;
(4)二氧化硫与足量氢氧化钠反应生成亚硫酸钠和水,离子方程式:2OH-+SO2=H2O+SO32-;
故答案为:2OH-+SO2=H2O+SO32-;
(5)铜与浓硝酸反应生成硝酸铜、二氧化碳和水,反应中硝酸中+5价的氮元素化合价降为二氧化氮中的+4价,所以硝酸为氧化剂,对应产物二氧化氮为还原产物;
故答案为:二氧化氮(NO2).
点评 本题为综合题,涉及电解质、非电解质判断,电离方程式、离子方程式书写,氧化还原反应进步概念判断,明确电解质、非电解质概念,电解质电离方式,发生反应实质是解题关键,题目难度不大.

 名校课堂系列答案
名校课堂系列答案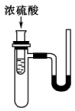 如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )
如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )| A. | 左高右低 | B. | 左低右高 | C. | 左右一样高 | D. | 来回振动 |
| A. | 钾离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散 | |
| B. | 高锰酸根离子受到钾离子的作用,克服了离子间的斥力,逐渐向水中扩散 | |
| C. | 高锰酸根离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散 | |
| D. | 高锰酸钾是强氧化剂,水被氧化 |
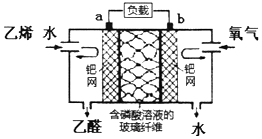
| A. | 该电化学装置是电解池 | |
| B. | a极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| C. | 氧气在b极被氧化 | |
| D. | 电子移动方向:电极a→负载→电极b→磷酸溶液→电极a |
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2Z | |
| C. | 改变温度可以改变此反应的平衡常数 | |
| D. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 |
:

(1)①中反应的离子方程式是3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+.
(2)②中逸出的无色气体是CO2.
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀. 甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的.其实验方案是取Ⅰ中所得溶液少许进行亚铁离子(或Fe2+)离子的检验.
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
| 实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液.溶液变无色 |
| ⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
Ⅱ.为探究④中溶液变无色的原因,进行如下实验:
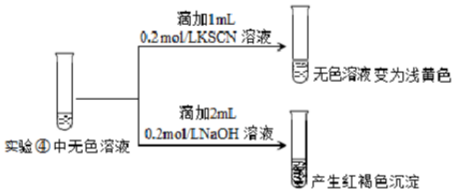
资料显示:FeF3溶液为无色.
用平衡移动原理解释红褐色沉淀产生的原因:无色溶液中存在平衡:Fe3++3F-?FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3.
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与碱性物质的pH、离子的性质有关.
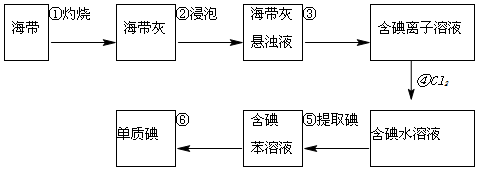 请填写下列空白:
请填写下列空白: