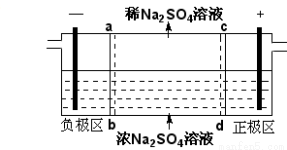
题目内容
19.硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用.某课外研究小组的同学用粗铜粉设计了两种制备胆矾的途径: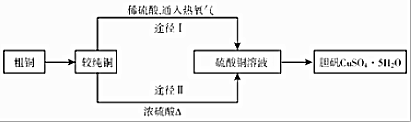
(1)分别写出两种途径涉及的化学方程式:
途径Ⅰ2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O
途径ⅡCu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)途径II中,若铜还有剩余,硫酸是否消耗完毕:否(填“是”或“否”).其理由是因随反应的进行,硫酸变稀,而稀H2SO4不与Cu反应,故H2SO4不会耗完
设计一个实验证明你的结论,写出你所设计实验的反应原理(用化学方程式表示)H2SO4+Fe=FeSO4+H2↑.
(3)比较制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
①产生等量胆矾,途径I消耗硫酸少②途径I不产生污染大气的气体.
分析 (1)途径Ⅰ由铜与稀硫酸与氧气反应生成硫酸;途径Ⅱ由铜与浓硫酸加热反应生成硫酸铜和二氧化硫的反应;
(2)途径Ⅱ随着反应的进行,浓硫酸变稀,反应停止;利用稀硫酸与活泼金属生成氢气检验稀硫酸;
(3)途径Ⅱ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体.
解答 解:(1)途径Ⅰ由铜与稀硫酸与氧气反应生成硫酸,反应为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;途径Ⅱ由铜与浓硫酸加热反应生成硫酸铜和二氧化硫,反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)浓硫酸与铜发生反应Cu+2H2SO4(浓)Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O随着反应的进行,浓硫酸浓度逐渐降低,稀硫酸与铜不反应,则硫酸不能消耗完毕,稀硫酸与活泼金属反应生成氢气,可想溶液中加入足量的铁粉,H2SO4+Fe=FeSO4+H2↑,检验生成的气体即可;
故答案为:否;因随反应的进行,硫酸变稀,而稀H2SO4不与Cu反应,故H2SO4不会耗完;H2SO4+Fe=FeSO4+H2↑;
(3)比较反应的两个途径,途径Ⅱ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体;
故答案为:产生等量胆矾,途径I消耗硫酸少;途径I不产生污染大气的气体.
点评 考查实验准备方案设计与绿色化学等,难度中等,注意实验方案设计应理论正确、操作简单可行、经济节约、绿色环保.

 智慧小复习系列答案
智慧小复习系列答案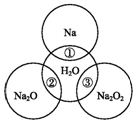 如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 反应③最多能产生0.1 mol O2 | |
| B. | 反应①的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2O2中阴阳离子数目之比为1:1 | |
| D. | ①②③充分反应后所得溶液中溶质的质量分数:②=③>① |
| A. | 钾离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散 | |
| B. | 高锰酸根离子受到钾离子的作用,克服了离子间的斥力,逐渐向水中扩散 | |
| C. | 高锰酸根离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散 | |
| D. | 高锰酸钾是强氧化剂,水被氧化 |
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2Z | |
| C. | 改变温度可以改变此反应的平衡常数 | |
| D. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 |
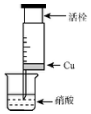 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.(1)甲组同学设计如图装置来证实稀稍酸与铜反应,步骤如下.
A.检验50ml针筒的气密性.
B.抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后针头朝上倒放,推活栓,使针头内充满水.
C.将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住.
回答以下相关问题:
①一段时间后在针筒内观察到溶液颜色为蓝色,有无色气体产生.该反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
②反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是往针筒内抽气,气体由无色变红棕色.
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如表:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?不同意(填“同意”或“不同意”),原因是相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同.结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.为了验证推断是否正确,三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生.认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议.请分析原因过量的硝酸分解会产生红棕色的NO2.
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色.请用方程式表示溶液颜色变化的反应原理4NO2+O2+2H2O=4HNO3.
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色.
③从环保的角度看,你认为三个方案中最好的是哪一个方案二.
:

(1)①中反应的离子方程式是3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+.
(2)②中逸出的无色气体是CO2.
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀. 甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的.其实验方案是取Ⅰ中所得溶液少许进行亚铁离子(或Fe2+)离子的检验.
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
| 实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液.溶液变无色 |
| ⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
Ⅱ.为探究④中溶液变无色的原因,进行如下实验:
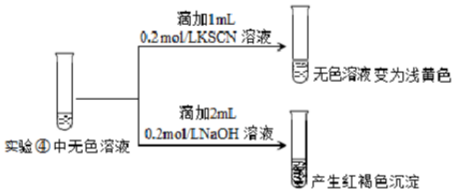
资料显示:FeF3溶液为无色.
用平衡移动原理解释红褐色沉淀产生的原因:无色溶液中存在平衡:Fe3++3F-?FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3.
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与碱性物质的pH、离子的性质有关.
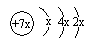 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为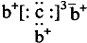 ,下列比较中正确的是( )
,下列比较中正确的是( )| A. | 原子半径:a>b>c | B. | 非金属性:a>c | ||
| C. | 氢化物的稳定性:c>a | D. | 最高价含氧酸的酸性:c>a |
| 选项 | 操作 | 目的 |
| A | 蒸馏 | 分离氯化钠和硝酸钾混合溶液 |
| B | 分液 | 分离乙酸与乙酸乙酯混合物 |
| C | 洗气 | 通入小苏打溶液中除去CO2中的HCl气体 |
| D | 用乙醇作萃取剂 | 提取溴水中的溴单质 |
| A. | A | B. | B | C. | C | D. | D |