题目内容
17.在下列水溶液中进行的反应,在反应过程中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键生成的是( )| A. | 2NaBr+Cl2═2NaCl+Br2 | B. | 2Na+H2O═2NaOH+H2 | ||
| C. | 2Na2O2+2H2O═2NaOH+O2 | D. | Na+Cl2═2NaCl |
分析 一般金属元素与非金属元素形成离子键,不同非金属元素之间形成极性共价键,同种非金属元素之间形成非极性共价键,化学变化中一定有旧键断裂和新键形成,以此来解答.
解答 解:A.反应物中有非极性键、离子键的断裂,生成物也只有非极性键、离子键的生成,没有极性键的断裂和生成,故A错误;
B.没有非极性键的断裂,有极性键和非极性键的生成,故B错误;
C.Na2O2为含有非极性键的离子化合物,H2O中含有极性键,生成物中,NaOH含有离子键和极性键,O2中含有非极性键,故C正确;
D.没有极性键、非极性键的形成,故D错误.
故选C.
点评 本题考查化学键和化学变化,明确常见物质中的化学键是解答本题的关键,熟悉判断化学键的一般规律及特殊物质中的化学键即可解答,题目难度不大.

练习册系列答案
相关题目
7.一氯甲烷的生产方法较多,包括甲烷氯化法、甲醇氯化法、光氯化法、氧氯化法等,一些工业过程也有副产物一氯甲烷.其中甲醇氯化法是由甲醇气体和盐酸在氯化锌水溶液中,于130-140℃下反应生成一氯甲烷,再经水洗、冷却、压缩、冷凝而得.下图是实验室模拟制造一氯甲烷的装置,装置中的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸.
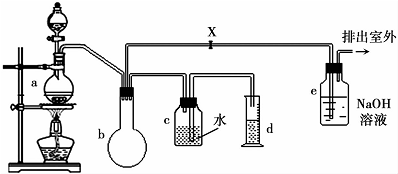
已知一氯甲烷的部分性质如下:
试回答以下问题:
(1)与甲烷氯化法相比,甲醇氯化法的优点是基本无副产品,原子利用率高.
(2)a中ZnCl2,由于加量过少仍需再加沸石以防暴沸,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是b(填正确答案标号).
a.立即补加 b.冷却后补加 c.不需补加 d.重新配料
(3)装置b仪器的名称圆底烧瓶,作用是防止倒吸、贮气、作安全瓶等.
(4)甲烷氯化法副产物CCl4与水混合后用分液漏斗分离,CCl4从下口放出(填“上口倒出”或“下口放出”).
(5)检验气体产物CH3Cl的方法是在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别).CH3Cl燃烧的化学方程式是2CH3Cl+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2HCl+2H2O.
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇和浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是甲醇和盐酸中的氯化氢都是易挥发的物质,在加热时挥发使得一氯甲烷的产率下降
(7)实验结束后,d中收集到的液体中含有一氯甲烷、甲醇、盐酸.
(8)甲醇在一定条件下还可生成二甲醚,二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇(E=5.39kW•h•kg-1)直接燃料电池的能量密度.若电解质为酸性,二甲醚直接燃料电池的理论输出电压为1.20V,能量密度E=8.64kW•h•kg-1
,已知能量密度E=电池输出电能/燃料质量,lkW•h=3.6×l06J,电子电量为1.6×10 -19C,NA为6.02×l023mol-l)

已知一氯甲烷的部分性质如下:
| 名称 | 熔点 | 沸点 | 溶解性 |
| 一氯甲烷 | -97.73℃ | -24.2℃ | 18℃时在水中微溶,与乙醚、丙酮或苯互溶,能溶于乙醇 |
(1)与甲烷氯化法相比,甲醇氯化法的优点是基本无副产品,原子利用率高.
(2)a中ZnCl2,由于加量过少仍需再加沸石以防暴沸,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是b(填正确答案标号).
a.立即补加 b.冷却后补加 c.不需补加 d.重新配料
(3)装置b仪器的名称圆底烧瓶,作用是防止倒吸、贮气、作安全瓶等.
(4)甲烷氯化法副产物CCl4与水混合后用分液漏斗分离,CCl4从下口放出(填“上口倒出”或“下口放出”).
(5)检验气体产物CH3Cl的方法是在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别).CH3Cl燃烧的化学方程式是2CH3Cl+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2HCl+2H2O.
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇和浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是甲醇和盐酸中的氯化氢都是易挥发的物质,在加热时挥发使得一氯甲烷的产率下降
(7)实验结束后,d中收集到的液体中含有一氯甲烷、甲醇、盐酸.
(8)甲醇在一定条件下还可生成二甲醚,二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇(E=5.39kW•h•kg-1)直接燃料电池的能量密度.若电解质为酸性,二甲醚直接燃料电池的理论输出电压为1.20V,能量密度E=8.64kW•h•kg-1
,已知能量密度E=电池输出电能/燃料质量,lkW•h=3.6×l06J,电子电量为1.6×10 -19C,NA为6.02×l023mol-l)
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 25℃时,pH=13的1.0 LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 常温常压下,4.4gCO2和N2O混合物中所含有的原子数为0.3 NA | |
| D. | 1L1 mol•L-1FeCl3完全水解生成NA个胶体粒子 |
12.下列金属晶体中,自由电子与金属阳离子间的作用力最弱的是( )
| A. | Na | B. | K | C. | Mg | D. | Al |
2.下列关于物质的检验说法不正确的是( )
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,原溶液含有SO42- | |
| B. | 某溶液先用稀硝酸酸化,再加入AgNO3溶液后有白色沉淀生成,证明原溶液中含有Cl- | |
| C. | 加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| D. | 向某溶液中加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色,说明原溶液中含有Fe2+ |
9.下列说法正确的是( )
| A. | 卤代烃中卤原子的检验:先加NaOH溶液,加热,冷却后加AgNO3溶液 | |
| B. | 除去乙烷中混有的乙烯,可用酸性KMnO4溶液洗气 | |
| C. | 碳原子数小于10,且一氯代物只有一种的烷烃有3种 | |
| D. | 可用水鉴别苯和四氯化碳 |
6.下列有关物质结构和元素周期律的表述正确的是( )
| A. | 主族元素的最高正价均等于其族序数 | |
| B. | 第2周期第ⅣA族元素的原子,核电荷数和中子数均为6 | |
| C. | 第ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 非金属元素的气态氢化物溶于水后,水溶液均呈酸性 |
7.化学兴趣小组对某工厂排放的废水取样检测得知废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
| A. | K+、NO3-、OH- | B. | K+、NO3-、SO42- | C. | Na+、Fe3+、Cl- | D. | Na+、CO32-、SO42- |
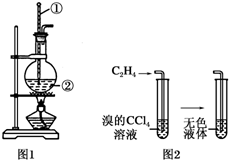 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题: