题目内容
7.一氯甲烷的生产方法较多,包括甲烷氯化法、甲醇氯化法、光氯化法、氧氯化法等,一些工业过程也有副产物一氯甲烷.其中甲醇氯化法是由甲醇气体和盐酸在氯化锌水溶液中,于130-140℃下反应生成一氯甲烷,再经水洗、冷却、压缩、冷凝而得.下图是实验室模拟制造一氯甲烷的装置,装置中的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸.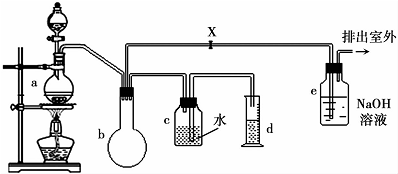
已知一氯甲烷的部分性质如下:
| 名称 | 熔点 | 沸点 | 溶解性 |
| 一氯甲烷 | -97.73℃ | -24.2℃ | 18℃时在水中微溶,与乙醚、丙酮或苯互溶,能溶于乙醇 |
(1)与甲烷氯化法相比,甲醇氯化法的优点是基本无副产品,原子利用率高.
(2)a中ZnCl2,由于加量过少仍需再加沸石以防暴沸,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是b(填正确答案标号).
a.立即补加 b.冷却后补加 c.不需补加 d.重新配料
(3)装置b仪器的名称圆底烧瓶,作用是防止倒吸、贮气、作安全瓶等.
(4)甲烷氯化法副产物CCl4与水混合后用分液漏斗分离,CCl4从下口放出(填“上口倒出”或“下口放出”).
(5)检验气体产物CH3Cl的方法是在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别).CH3Cl燃烧的化学方程式是2CH3Cl+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2HCl+2H2O.
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇和浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是甲醇和盐酸中的氯化氢都是易挥发的物质,在加热时挥发使得一氯甲烷的产率下降
(7)实验结束后,d中收集到的液体中含有一氯甲烷、甲醇、盐酸.
(8)甲醇在一定条件下还可生成二甲醚,二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇(E=5.39kW•h•kg-1)直接燃料电池的能量密度.若电解质为酸性,二甲醚直接燃料电池的理论输出电压为1.20V,能量密度E=8.64kW•h•kg-1
,已知能量密度E=电池输出电能/燃料质量,lkW•h=3.6×l06J,电子电量为1.6×10 -19C,NA为6.02×l023mol-l)
分析 (1)根据元素守恒可知,甲烷氯化法制一氯甲烷,有氯化氢生成,氯原子的利用率低,甲醇氯化法制一氯甲烷,有水生成,氯原子的利用率高,同时不会产生有污染的物质;
(2)实验中为防止暴沸,加入沸石,如果忘记没有加,应等溶液冷却后补加,据此答题;
(3)根据装置图可知b仪器的名称是圆底烧瓶,在装置图中的作用是防止倒吸、贮气、作安全瓶等;
(4)CCl4的密度大于水,所以与水混合后用分液漏斗分离,CCl4从下口放出;
(5)根据元素守恒可知,CH3Cl燃烧生成二氧化碳、水、氯化氢,据此书写化学方程式;
(6)甲醇和盐酸中的氯化氢都是易挥发的物质,在制取一氯甲烷时会由于挥发使得一氯甲烷的产率下降;
(7)一氯甲烷微溶于水,甲醇和氯化氢都易溶于水,所以实验结束后,d中收集到的液体中上述三种物质都会有;
(8)计算1Kg二甲醚输出的电能,结合$能量密度E=\frac{电池输出电能}{燃料质量}$计算.
解答 解:(1)根据元素守恒可知,甲烷氯化法制一氯甲烷,有氯化氢生成,氯原子的利用率低,甲醇氯化法制一氯甲烷,有水生成,氯原子的利用率高,同时不会产生有污染的物质,
故答案为:基本无副产品,原子利用率高;
(2)实验中为防止暴沸,加入沸石,如果忘记没有加,应等溶液冷却后补加,故选b;
(3)根据装置图可知b仪器的名称是圆底烧瓶,在装置图中的作用是防止倒吸、贮气、作安全瓶等,
故答案为:圆底烧瓶;防止倒吸、贮气、作安全瓶等;
(4)CCl4的密度大于水,所以与水混合后用分液漏斗分离,CCl4从下口放出,
故答案为:下口放出;
(5)根据元素守恒可知,CH3Cl燃烧生成二氧化碳、水、氯化氢,反应的化学方程式为2CH3Cl+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2HCl+2H2O,
故答案为:2CH3Cl+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2HCl+2H2O;
(6)甲醇和盐酸中的氯化氢都是易挥发的物质,在制取一氯甲烷时会由于挥发使得一氯甲烷的产率下降,
故答案为:甲醇和盐酸中的氯化氢都是易挥发的物质,在加热时挥发使得一氯甲烷的产率下降;
(7)一氯甲烷微溶于水,甲醇和氯化氢都易溶于水,所以实验结束后,d中收集到的液体中上述三种物质都会有,
故答案为:一氯甲烷、甲醇、盐酸;
(8)1Kg二甲醚输出的电能:w=UIt=Uq=1.20×$\frac{1000}{46}$×12×6.02×1023×1.6×10-19J=3.11×107 J=$\frac{3.11×1{0}^{7}}{3.6×1{0}^{6}}$kW•h=8.38 kW•h,所以二甲醚燃料电池能量密度E=8.64 kW•h•kg-1,
故答案为:8.64 kW•h•kg-1.
点评 本题以一氯甲烷的制备为载体综合考查学生的分析能力和实验能力,为高考常见题型和高频考点,注意把握物质的性质以及实验原理的理解,难度中等.

| A. | Na与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | CuSO4溶液与NaOH溶液的反应:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 氨气与稀盐酸的反应:NH3+HCl═NH4++Cl- | |
| D. | Ba(OH)2溶液与稀硫酸的反应:OH-+H+═H2O |

| A. | 等浓度的H2CO3、Na2CO3溶液中c(HCO3-)前者小 | |
| B. | 反应HCO3-+H2O?H2CO3+OH-的平衡常数为10-5.37 | |
| C. | 1L0.1mol•L-1NaHC2O4溶液和1L0.1mol•L-1的NaOH溶液混合,混合液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | Na2CO3溶液中加入过量草酸溶液,发生反应:CO32-+H2C2O4═HCO3-+HC2O4- |
| A. | HCl、CuCl2、Ba(OH)2 | B. | NaOH、CuSO4、H2SO4 | ||
| C. | Ba(OH)2、H2SO4、K2SO4 | D. | NaBr、H2SO4、Ba(OH)2 |
| A. | 2NaBr+Cl2═2NaCl+Br2 | B. | 2Na+H2O═2NaOH+H2 | ||
| C. | 2Na2O2+2H2O═2NaOH+O2 | D. | Na+Cl2═2NaCl |
 的单体为
的单体为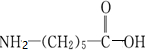 ,反应类型为缩聚反应.
,反应类型为缩聚反应.