题目内容
6.下列有关物质结构和元素周期律的表述正确的是( )| A. | 主族元素的最高正价均等于其族序数 | |
| B. | 第2周期第ⅣA族元素的原子,核电荷数和中子数均为6 | |
| C. | 第ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 非金属元素的气态氢化物溶于水后,水溶液均呈酸性 |
分析 A.主族元素中F、O没有正价;
B.第二周期ⅣA族元素的为C元素,则原子核电荷数一定为6,但中子数不一定为6;
B.同周期从左向右元素的非金属性增强;
D.氨气溶于水,溶于显碱性.
解答 解:A.一般主族元素的最高正价均等于其族序数,但主族元素中F、O没有正价,则O、F除外,故A错误;
B.第二周期ⅣA族元素的为C元素,则原子核电荷数一定为6,但中子数不一定为6,如13C的中子数为7,故B错误;
C.因同周期从左向右元素的非金属性增强,则ⅦA族元素是同周期中非金属性最强的元素,故C正确;
D.绝大多数非金属元素的气态氢化物溶于水后,水溶液为酸性,但氨气溶于水,溶于显碱性,故D错误;
故选C.
点评 本题考查元素周期律内容及应用,题目难度中等,熟悉元素周期律即可解答,但应注意利用特例来分析解答,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
17.在下列水溶液中进行的反应,在反应过程中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键生成的是( )
| A. | 2NaBr+Cl2═2NaCl+Br2 | B. | 2Na+H2O═2NaOH+H2 | ||
| C. | 2Na2O2+2H2O═2NaOH+O2 | D. | Na+Cl2═2NaCl |
1.下列各分子中所有原子的最外电子层均达到8电子稳定结构的是( )
| A. | N2 | B. | HClO | C. | CH4 | D. | BF3 |
18.一定温度下,在2.0L的密闭容器中充入0.1molN2O和0.1molCO,在一定条件下发生催化反应:N2O(g)+CO(g)?催化剂N2(g)+CO2(g).依据下列图象作出的判断正确的是( )
| A. | 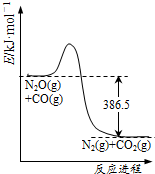 由图可判断该反应的正反应为放热反应 | |
| B. | 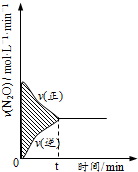 由图可判断阴影部分面积的数值为0.05 | |
| C. | 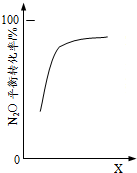 由图可判断横坐标X可能是压强 | |
| D. |  图研究的是不同催化剂对反应的影响,则甲使用的催化剂效率较高 |


 (填结构简式)可以合成下列二肽:
(填结构简式)可以合成下列二肽:

 .
.