题目内容
8.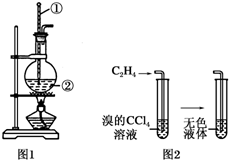 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:(1)图1中仪器①、②的名称分别为温度计、圆底烧瓶.
(2)收集乙烯气体最好的方法是排水集气法.
(3)向溴的四氯化碳溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于加成反应(填反应类型)
分析 (1)根据仪器①②的构造写出仪器①②的名称;
(2)空气的平均分子量为29,乙烯的分子量为28,二者比较接近,不能使用排空气法收集,乙烯不溶于水,可用排水法收集;
(3)乙烯分子中含有碳碳双键,能够与溴的四氯化碳发生加成反应生成1,2-二溴乙烷.
解答 解:(1)图1中仪器①用于测量反应温度,名称为温度计;仪器②由于盛放乙醇和浓硫酸的混合液,名称为圆底烧瓶,
故答案为:温度计;圆底烧瓶;
(2)乙烯的密度与空气密度接近,不能使用排空气法收集,乙烯不溶于水,可以用排水法水解乙烯,
故答案为:排水集气法;
(3)向溴的四氯化碳溶液中通入乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,所以溶液的颜色很快褪去,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,
故答案为:加成反应.
点评 本题主要考查了乙烯的实验室制法,题目难度不大,注意掌握常见仪器的干燥及使用方法,明确乙烯的实验室制法及反应原理.

练习册系列答案
相关题目
19.下列各组中,用惰性电极电解每种电解质溶液时只生成氢气和氧气的是( )
| A. | HCl、CuCl2、Ba(OH)2 | B. | NaOH、CuSO4、H2SO4 | ||
| C. | Ba(OH)2、H2SO4、K2SO4 | D. | NaBr、H2SO4、Ba(OH)2 |
3.将29g乙烯和乙烷的混合气体通入足量的溴水后,溴水增重14g,则混合气体中乙烯的体积分数是( )
| A. | 75% | B. | 50% | C. | 30% | D. | 25% |
13.四种短周期元素在周期表中的位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素Z位于周期表中第三周期,VA族;
(2)比较X与Y的气态氢化物的稳定性:NH3>CH4(写化学式);
(3)XW2的电子式为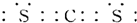 ;
;
(4)比较X、Y、Z、W四种原子半径由大到小关系:P>S>C>N;
(5)X和W形成的化合物属于共价化合物 (填“离子化合物”、或“共价化合物”),该化合物中存在的微粒间作用力有:共价键和分子间作用力.
| X | Y | |
| Z | W |
(1)元素Z位于周期表中第三周期,VA族;
(2)比较X与Y的气态氢化物的稳定性:NH3>CH4(写化学式);
(3)XW2的电子式为
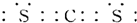 ;
;(4)比较X、Y、Z、W四种原子半径由大到小关系:P>S>C>N;
(5)X和W形成的化合物属于共价化合物 (填“离子化合物”、或“共价化合物”),该化合物中存在的微粒间作用力有:共价键和分子间作用力.
17.在下列水溶液中进行的反应,在反应过程中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键生成的是( )
| A. | 2NaBr+Cl2═2NaCl+Br2 | B. | 2Na+H2O═2NaOH+H2 | ||
| C. | 2Na2O2+2H2O═2NaOH+O2 | D. | Na+Cl2═2NaCl |
18.一定温度下,在2.0L的密闭容器中充入0.1molN2O和0.1molCO,在一定条件下发生催化反应:N2O(g)+CO(g)?催化剂N2(g)+CO2(g).依据下列图象作出的判断正确的是( )
| A. | 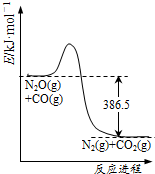 由图可判断该反应的正反应为放热反应 | |
| B. | 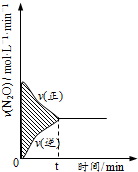 由图可判断阴影部分面积的数值为0.05 | |
| C. | 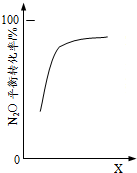 由图可判断横坐标X可能是压强 | |
| D. |  图研究的是不同催化剂对反应的影响,则甲使用的催化剂效率较高 |


