题目内容
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 25℃时,pH=13的1.0 LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 常温常压下,4.4gCO2和N2O混合物中所含有的原子数为0.3 NA | |
| D. | 1L1 mol•L-1FeCl3完全水解生成NA个胶体粒子 |
分析 A、NaHSO4晶体中含Na+和HSO4-;
B、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L;
C、CO2和N2O的摩尔质量均为44g/mol,且均含3个原子;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、NaHSO4晶体中含Na+和HSO4-,故0.1molNaHSO4晶体中含有的阳离子和阴离子总数为0.2NA个离子,故A错误;
B、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中含有的氢氧根的物质的量为0.1mol,故含0.1NA个氢氧根,故B错误;
C、CO2和N2O的摩尔质量均为44g/mol,故4.4g混合物的物质的量为0.1mol,由于两者均含3个原子,故0.1mol混合物中含0.3NA个原子,故C正确;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故所得的氢氧化铁胶粒的个数小于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
5.H2CO3和H2C2O4都是二元弱酸,不同pH环境下它们不同形态的粒子的组成百分率如图所示,下列说法正确的是( )


| A. | 等浓度的H2CO3、Na2CO3溶液中c(HCO3-)前者小 | |
| B. | 反应HCO3-+H2O?H2CO3+OH-的平衡常数为10-5.37 | |
| C. | 1L0.1mol•L-1NaHC2O4溶液和1L0.1mol•L-1的NaOH溶液混合,混合液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | Na2CO3溶液中加入过量草酸溶液,发生反应:CO32-+H2C2O4═HCO3-+HC2O4- |
13.四种短周期元素在周期表中的位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素Z位于周期表中第三周期,VA族;
(2)比较X与Y的气态氢化物的稳定性:NH3>CH4(写化学式);
(3)XW2的电子式为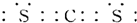 ;
;
(4)比较X、Y、Z、W四种原子半径由大到小关系:P>S>C>N;
(5)X和W形成的化合物属于共价化合物 (填“离子化合物”、或“共价化合物”),该化合物中存在的微粒间作用力有:共价键和分子间作用力.
| X | Y | |
| Z | W |
(1)元素Z位于周期表中第三周期,VA族;
(2)比较X与Y的气态氢化物的稳定性:NH3>CH4(写化学式);
(3)XW2的电子式为
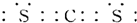 ;
;(4)比较X、Y、Z、W四种原子半径由大到小关系:P>S>C>N;
(5)X和W形成的化合物属于共价化合物 (填“离子化合物”、或“共价化合物”),该化合物中存在的微粒间作用力有:共价键和分子间作用力.
10.在光照条件下,将1mol CH4与Cl2反应,得到等物质的量的4种取代物,则耗Cl2物质的量为( )
| A. | 1 mol | B. | 2 mol | C. | 2.5 mol | D. | 10 mol |
17.在下列水溶液中进行的反应,在反应过程中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键生成的是( )
| A. | 2NaBr+Cl2═2NaCl+Br2 | B. | 2Na+H2O═2NaOH+H2 | ||
| C. | 2Na2O2+2H2O═2NaOH+O2 | D. | Na+Cl2═2NaCl |




 (填结构简式)可以合成下列二肽:
(填结构简式)可以合成下列二肽:

 .
.