题目内容
2.下列关于物质的检验说法不正确的是( )| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,原溶液含有SO42- | |
| B. | 某溶液先用稀硝酸酸化,再加入AgNO3溶液后有白色沉淀生成,证明原溶液中含有Cl- | |
| C. | 加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| D. | 向某溶液中加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色,说明原溶液中含有Fe2+ |
分析 A.检验SO42-离子应排除SO32-离子和Ag+离子的干扰,亚硫酸根离子易被硝酸氧化为硫酸根离子,硫酸钡和氯化银都不溶于硝酸;
B.氯离子的检验方法是硝酸酸化排除其他离子干扰,再加入AgNO3溶液后有白色沉淀生成证明氯离子存在;
C.铵根离子结合氢氧根离子加热反应生成使红色石蕊试纸变蓝色的气体为氨气;
D.氢氧化亚铁是白色沉淀,在空气中会迅速变化为灰绿色最后变化为红褐色沉淀;
解答 解:A.滴加BaCl2溶液不能排除银离子和亚硫酸根离子的干扰,氯化银难溶于硝酸,亚硫酸钡被稀硝酸氧化为硫酸钡,故A错误;
B.氯离子的检验方法为:先用稀硝酸酸化,再加入AgNO3溶液后有白色沉淀生成,证明原溶液中含有Cl-,故B正确;
C.溶液中加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成为氨气,则证明原溶液中一定含有NH4+,故C正确;
D.亚铁盐溶液中加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色,说明原溶液中含有Fe2+,故D正确;
故选A.
点评 本题考查了硫酸根离子、氯离子、铵根离子、亚铁离子的检验,但要注意排除某些离子的干扰以及应该加入什么试剂才能排除这些离子的干扰来解答,题目难度不大.

练习册系列答案
相关题目
13.四种短周期元素在周期表中的位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素Z位于周期表中第三周期,VA族;
(2)比较X与Y的气态氢化物的稳定性:NH3>CH4(写化学式);
(3)XW2的电子式为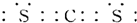 ;
;
(4)比较X、Y、Z、W四种原子半径由大到小关系:P>S>C>N;
(5)X和W形成的化合物属于共价化合物 (填“离子化合物”、或“共价化合物”),该化合物中存在的微粒间作用力有:共价键和分子间作用力.
| X | Y | |
| Z | W |
(1)元素Z位于周期表中第三周期,VA族;
(2)比较X与Y的气态氢化物的稳定性:NH3>CH4(写化学式);
(3)XW2的电子式为
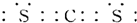 ;
;(4)比较X、Y、Z、W四种原子半径由大到小关系:P>S>C>N;
(5)X和W形成的化合物属于共价化合物 (填“离子化合物”、或“共价化合物”),该化合物中存在的微粒间作用力有:共价键和分子间作用力.
10.在光照条件下,将1mol CH4与Cl2反应,得到等物质的量的4种取代物,则耗Cl2物质的量为( )
| A. | 1 mol | B. | 2 mol | C. | 2.5 mol | D. | 10 mol |
17.在下列水溶液中进行的反应,在反应过程中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键生成的是( )
| A. | 2NaBr+Cl2═2NaCl+Br2 | B. | 2Na+H2O═2NaOH+H2 | ||
| C. | 2Na2O2+2H2O═2NaOH+O2 | D. | Na+Cl2═2NaCl |
7.下列各组中的反应,属于同一反应类型的是( )
| A. | 由溴丙烷水解制取丙醇;由丙烯与水反应制取丙醇 | |
| B. | 由乙酸和乙醇制取乙酸乙酯;由苯甲酸乙酯制取苯甲酸和乙醇 | |
| C. | 由氯代环己烷制取环己烯;由丙烯制取1,2-二溴丙烷 | |
| D. | 由甲苯制取对硝基甲苯;由甲苯制取苯甲酸 |
 的单体为
的单体为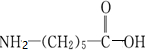 ,反应类型为缩聚反应.
,反应类型为缩聚反应.
 (填结构简式)可以合成下列二肽:
(填结构简式)可以合成下列二肽:

 .
.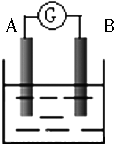 如图为原电池装置示意图:
如图为原电池装置示意图: