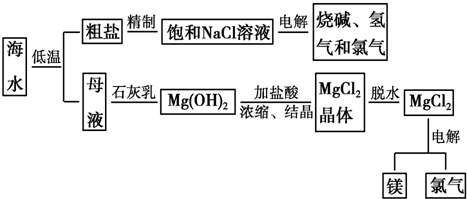
题目内容
15.下列实验操作正确的是( )| A. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| B. | 稀释浓硫酸时,常把水加入到盛浓硫酸的烧杯中 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 不慎将浓硫酸溅到皮肤上,应先用布拭去再用水冲洗 |
分析 A.加热液体时要防止液体暴沸;
B.稀释浓硫酸时,应防止酸液飞溅;
C.做CO还原Fe2O3实验时,应先停止加热;
D.最后涂上3%~5%的小苏打溶液.
解答 解:A.加热液体时要防止液体暴沸,可加入碎瓷片,故A正确;
B.稀释浓硫酸时,应把浓硫酸加入到水中,并不断搅拌,防止酸液飞溅,故B错误;
C.做CO还原Fe2O3实验时,应先停止加热,防止Fe重新被氧化,故C错误;
D.浓硫酸不慎溅到皮肤上,先用干布拭去,然后用大量水冲洗,再涂上3%~5%的小苏打溶液,故D错误.
故选A.
点评 本题考查较为综合,涉及液体的加热、浓硫酸的稀释以及气体的收集等,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 常温下,将pH=10的氨水溶液稀释到原体积的10倍后,溶液的pH=9 | |
| B. | 25℃时,分别向体积均为10mL pH=3的HCl和pH=3的CH3COOH溶液中,滴加0.1mol•L-1的NaOH溶液,至中性时,盐酸消耗的氢氧化钠体积多 | |
| C. | 向0.05mol•L-1的Na2CO3溶液中加入0.05mol CaO,溶液中$\frac{c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$减小 | |
| D. | 25℃时氯气-氯水体系汇总存在以下平衡关系:c(H+)-c(OH-)=2c(ClO-)+c(HClO) |
6.a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.下列叙述错误的是( )
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与其他元素生成的化合物都是离子化合物 | |
| D. | a.b.c.d与氢形成的化合物中化学键均为极性共价键 |
3.某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为2Ag++O2+2SO32-=Ag2SO4↓+SO42-.
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是证明X不是Ag2O.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
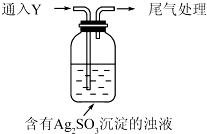
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O$\frac{\underline{\;H+\;}}{\;}$2Ag+H2SO4.
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为2Ag++O2+2SO32-=Ag2SO4↓+SO42-.
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是证明X不是Ag2O.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O$\frac{\underline{\;H+\;}}{\;}$2Ag+H2SO4.

10.下列说法中错误的是( )
| A. | KAl(SO4)2•12H2O不属于配合物 | |
| B. | 配位化合物中的配体可以是分子也可以是阴离子 | |
| C. | 配位数为4的配合物均为正四面体结构 | |
| D. | 已知[Cu(NH3)2]2+的空间构型为直线型,则它的中心原子采用sp杂化 |
20.2008年4月22日是第39个“世界地球日”,今年我国确定的主题是“认识地球,和谐发展”.下列行为不符合这一主题的是( )
| A. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| B. | 减少氟氯烃气体的使用,保护臭氧层免遭破坏 | |
| C. | 大量砍伐树木,制造生活必需品,从而降低物价,维持社会和谐 | |
| D. | 提倡每个人都要有“节能减排”的观念,在生活细节中也要点点滴滴地节约能源 |
7.下列电子式正确的是( )
| A. |  | B. |  | C. |  | D. |  |
5.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图 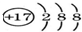 | |
| B. | 溴化钠的电子式: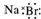 | |
| C. | 氯化镁的电子式: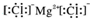 | |
| D. | 用电子式表示氯化氢分子的形成过程: |