题目内容
10.某研究小组欲探究SO2的化学性质,设计了如下实验方案.
(1)在B中检验SO2的氧化性,则B中所盛试剂可为硫化钠溶液.
(2)在C中装KMnO4溶液,检验SO2的还原性,则C中反应的化学方程式为5SO2+2KMnO4+2H2O=2MnSO4+K2SO4+2H2SO4.吸收多余SO2的方程式为SO2+2NaOH=Na2SO3+H2O.
(3)在D中装新制漂白粉浓溶液.通入SO2一段时间后,D中出现了大量白色沉淀.同学们对白色沉淀成分进行了三种假设.请回答下列问题:
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为CaSO4;
假设三:该白色沉淀为上述两种物质的混合物.
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:Ca(ClO)2+H2O+SO2=CaSO4+2HCl.
分析 (1)二氧化硫氧化性较弱,能够氧化硫化钠;
(2)高锰酸钾氧化二氧化硫生成硫酸,二氧化硫有毒,能够与氢氧化钠反应生成亚硫酸钠和水;
(3)(ⅰ)新制漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化亚硫酸根离子;
(ⅲ)漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化+4价的硫,据此书写化学方程式;
解答 解:(1)二氧化硫氧化性较弱,能够氧化硫化钠,反应得到硫单质,现象产生浑浊;
故答案为:硫化钠溶液;
(2)二氧化硫具有强的还原性,能够被酸性高锰酸钾氧化,化学方程式:5SO2+2KMnO4+2H2O=2MnSO4+K2SO4+2H2SO4;
二氧化硫有毒,能够与氢氧化钠反应生成亚硫酸钠和水,方程式:SO2+2NaOH=Na2SO3+H2O;
故答案为:5SO2+2KMnO4+2H2O=2MnSO4+K2SO4+2H2SO4;SO2+2NaOH=Na2SO3+H2O;
(3)(ⅰ)新制漂白粉浓溶液中含有的次氯酸根离子具有强氧化性,二氧化硫具有还原性,会发生氧化还原反应,生成产物为硫酸钙,
故答案为:CaSO4;
(ⅲ)漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化+4价的硫,所以生成该白色沉淀的化学方程式:Ca(ClO)2+H2O+SO2=CaSO4+2HCl,
故答案为:Ca(ClO)2+H2O+SO2=CaSO4+2HCl;
点评 本题主要考查了探究SO2的化学性质实验操作,掌握实验的原理及二氧化硫的性质是解题的关键,题目难度中等.

练习册系列答案
相关题目
20.2008年4月22日是第39个“世界地球日”,今年我国确定的主题是“认识地球,和谐发展”.下列行为不符合这一主题的是( )
| A. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| B. | 减少氟氯烃气体的使用,保护臭氧层免遭破坏 | |
| C. | 大量砍伐树木,制造生活必需品,从而降低物价,维持社会和谐 | |
| D. | 提倡每个人都要有“节能减排”的观念,在生活细节中也要点点滴滴地节约能源 |
1.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 单质的氧化性减弱 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
18.粗盐中含有不溶性泥沙,可溶性的CaCl2、MgCl2以及一些硫酸盐等.精制食盐水的实验操作顺序如下:①加入过量BaCl2溶液,②加入过量NaOH溶液,③加入过量Na2CO3溶液,④过滤,⑤加入适量盐酸.下列说法不正确的是( )
| A. | ①②③中加入过量的试剂是为了完全除去相应的杂质离子 | |
| B. | ③中加入过量Na2CO3溶液仅为了完全除去Ca2+ | |
| C. | 因为Mg(OH)2难溶而MgCO3微溶,所以用NaOH除Mg2+效果比用Na2CO3好 | |
| D. | ⑤中可以通过边滴加边测定溶液pH的方法,控制加入的盐酸“适量” |
5.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图  | |
| B. | 溴化钠的电子式: | |
| C. | 氯化镁的电子式: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
15.下列关于卤素的叙述说法错误的是( )
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 元素的最高化合价均为+7 | |
| C. | 从上到下原子半径递增 | |
| D. | 从上到下非金属性减弱 |
2.化学家们合成了如图所示的一系列星烷,如三星烷、四星烷、五星烷等.下列说法不正确的是( )

| A. | 三星烷与丙苯互为同分异构体 | B. | 五星烷的二氯取代物有8种 | ||
| C. | 六星烷的化学式为C18H24 | D. | 七星烷的一硝基取代物有2种 |
19.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| B. | 1.4g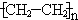 中含有的碳原子数为0.2NA 中含有的碳原子数为0.2NA | |
| C. | 1 mol苯分子中含有C=C双键数为3NA | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成水分子数为3NA |
20.${\;}_{86}^{222}$Rn、${\;}_{86}^{219}$Rn是( )
| A. | 两种元素 | B. | 互为同位素 | C. | 同种核素 | D. | 同一原子 |